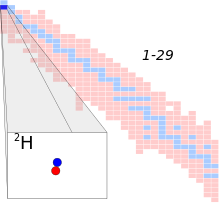
 Deuterium isotope highlighted on a truncated table of nuclides for atomic numbers 1 through 29. Number of neutrons starts at zero and increases downward. Number of protons starts at one and increases rightward. Stable isotopes in blue. | |
| General | |
|---|---|
| Symbol | 2H |
| Names | Deuterium, hydrogen-2, 2 H , H-2, hydrogen-2, D, 2 H |
| Protons (Z) | 1 |
| Neutrons (N) | 1 |
| Nuclide data | |
| Natural abundance | 0.0156% (Earth)[1] |
| Isotope mass | 2.01410177811[2] Da |
| Spin | 1+ |
| Excess energy | 13135.720±0.001 keV |
| Binding energy | 2224.52±0.20 keV |
| Isotopes of hydrogen Complete table of nuclides |
Deuterium (or hydrogen-2, symbol 2
H
or D, also known as heavy hydrogen) is one of two stable isotopes of hydrogen (the other being protium, or hydrogen-1). The nucleus of a deuterium atom, called a deuteron, contains one proton and one neutron, whereas the far more common protium has no neutrons in the nucleus. Deuterium has a natural abundance in Earth’s oceans of about one atom of deuterium among all 6420 atoms of hydrogen (see heavy water). Thus deuterium accounts for approximately 0.0156% by number (0.0312% by mass) of all the naturally occurring hydrogen in the oceans, while protium accounts for more than 99.98%. The abundance of deuterium changes slightly from one kind of natural water to another (see Vienna Standard Mean Ocean Water). (Tritium is yet another hydrogen isotope with symbol 3
H
or T. It has two neutrons, and is radioactive and far more rare than deuterium.)
The name deuterium is derived from the Greek deuteros, meaning «second», to denote the two particles composing the nucleus.[3] Deuterium was discovered by American chemist Harold Urey in 1931. Urey and others produced samples of heavy water in which the deuterium content had been highly concentrated. The discovery of deuterium won Urey a Nobel Prize in 1934.
Deuterium is destroyed in the interiors of stars faster than it is produced. Other natural processes are thought to produce only an insignificant amount of deuterium. Nearly all deuterium found in nature was produced in the Big Bang 13.8 billion years ago, as the basic or primordial ratio of hydrogen-1 to deuterium (about 26 atoms of deuterium per million hydrogen atoms) has its origin from that time. This is the ratio found in the gas giant planets, such as Jupiter. The analysis of deuterium–protium ratios in comets found results very similar to the mean ratio in Earth’s oceans (156 atoms of deuterium per million hydrogen atoms). This reinforces theories that much of Earth’s ocean water is of cometary origin.[4][5] The deuterium–protium ratio of the comet 67P/Churyumov–Gerasimenko, as measured by the Rosetta space probe, is about three times that of Earth water. This figure is the highest yet measured in a comet.[6]
Deuterium–protium ratios thus continue to be an active topic of research in both astronomy and climatology.
Differences from common hydrogen (protium)[edit]
Chemical symbol[edit]

Deuterium is frequently represented by the chemical symbol D. Since it is an isotope of hydrogen with mass number 2, it is also represented by 2
H
. IUPAC allows both D and 2
H
, although 2
H
is preferred.[7] A distinct chemical symbol is used for convenience because of the isotope’s common use in various scientific processes. Also, its large mass difference with protium (1H) (deuterium has a mass of 2.014102 u, compared to the mean hydrogen atomic weight of 1.007947 u, and protium’s mass of 1.007825 u) confers non-negligible chemical dissimilarities with protium-containing compounds, whereas the isotope weight ratios within other chemical elements are largely insignificant in this regard.
Spectroscopy[edit]
In quantum mechanics the energy levels of electrons in atoms depend on the reduced mass of the system of electron and nucleus. For the hydrogen atom, the role of reduced mass is most simply seen in the Bohr model of the atom, where the reduced mass appears in a simple calculation of the Rydberg constant and Rydberg equation, but the reduced mass also appears in the Schrödinger equation, and the Dirac equation for calculating atomic energy levels.
The reduced mass of the system in these equations is close to the mass of a single electron, but differs from it by a small amount about equal to the ratio of mass of the electron to the atomic nucleus. For hydrogen, this amount is about 1837/1836, or 1.000545, and for deuterium it is even smaller: 3671/3670, or 1.0002725. The energies of spectroscopic lines for deuterium and light hydrogen (hydrogen-1) therefore differ by the ratios of these two numbers, which is 1.000272. The wavelengths of all deuterium spectroscopic lines are shorter than the corresponding lines of light hydrogen, by a factor of 1.000272. In astronomical observation, this corresponds to a blue Doppler shift of 0.000272 times the speed of light, or 81.6 km/s.[8]
The differences are much more pronounced in vibrational spectroscopy such as infrared spectroscopy and Raman spectroscopy,[9] and in rotational spectra such as microwave spectroscopy because the reduced mass of the deuterium is markedly higher than that of protium. In nuclear magnetic resonance spectroscopy, deuterium has a very different NMR frequency (e.g. 61 MHz when protium is at 400 MHz) and is much less sensitive. Deuterated solvents are usually used in protium NMR to prevent the solvent from overlapping with the signal, although deuterium NMR on its own right is also possible.
Big Bang nucleosynthesis[edit]
Deuterium is thought to have played an important role in setting the number and ratios of the elements that were formed in the Big Bang. Combining thermodynamics and the changes brought about by cosmic expansion, one can calculate the fraction of protons and neutrons based on the temperature at the point that the universe cooled enough to allow formation of nuclei. This calculation indicates seven protons for every neutron at the beginning of nucleogenesis, a ratio that would remain stable even after nucleogenesis was over. This fraction was in favor of protons initially, primarily because the lower mass of the proton favored their production. As the Universe expanded, it cooled. Free neutrons and protons are less stable than helium nuclei, and the protons and neutrons had a strong energetic reason to form helium-4. However, forming helium-4 requires the intermediate step of forming deuterium.
Through much of the few minutes after the Big Bang during which nucleosynthesis could have occurred, the temperature was high enough that the mean energy per particle was greater than the binding energy of weakly bound deuterium; therefore any deuterium that was formed was immediately destroyed. This situation is known as the deuterium bottleneck. The bottleneck delayed formation of any helium-4 until the Universe became cool enough to form deuterium (at about a temperature equivalent to 100 keV). At this point, there was a sudden burst of element formation (first deuterium, which immediately fused to helium). However, very shortly thereafter, at twenty minutes after the Big Bang, the Universe became too cool for any further nuclear fusion and nucleosynthesis to occur. At this point, the elemental abundances were nearly fixed, with the only change as some of the radioactive products of Big Bang nucleosynthesis (such as tritium) decay.[10] The deuterium bottleneck in the formation of helium, together with the lack of stable ways for helium to combine with hydrogen or with itself (there are no stable nuclei with mass numbers of five or eight) meant that an insignificant amount of carbon, or any elements heavier than carbon, formed in the Big Bang. These elements thus required formation in stars. At the same time, the failure of much nucleogenesis during the Big Bang ensured that there would be plenty of hydrogen in the later universe available to form long-lived stars, such as our Sun.
Abundance[edit]
Deuterium occurs in trace amounts naturally as deuterium gas, written 2
H
2 or D2, but most of the naturally occurring deuterium atoms in the Universe are bonded with a typical 1
H
atom to form a gas called hydrogen deuteride (HD or 1
H
2
H
).[11] Similarly, natural water contains trace amounts of deuterated molecules, almost all as semiheavy water HDO with only one deuterium atom.
The existence of deuterium on Earth, elsewhere in the Solar System (as confirmed by planetary probes), and in the spectra of stars, is also an important datum in cosmology. Gamma radiation from ordinary nuclear fusion dissociates deuterium into protons and neutrons, and there are no known natural processes other than the Big Bang nucleosynthesis that might have produced deuterium at anything close to its observed natural abundance. Deuterium is produced by the rare cluster decay, and occasional absorption of naturally occurring neutrons by light hydrogen, but these are trivial sources. There is thought to be little deuterium in the interior of the Sun and other stars, as at these temperatures the nuclear fusion reactions that consume deuterium happen much faster than the proton-proton reaction that creates deuterium. However, deuterium persists in the outer solar atmosphere at roughly the same concentration as in Jupiter, and this has probably been unchanged since the origin of the Solar System. The natural abundance of deuterium seems to be a very similar fraction of hydrogen, wherever hydrogen is found, unless there are obvious processes at work that concentrate it.
The existence of deuterium at a low but constant primordial fraction in all hydrogen is another one of the arguments in favor of the Big Bang theory over the Steady State theory of the Universe. The observed ratios of hydrogen to helium to deuterium in the universe are difficult to explain except with a Big Bang model. It is estimated that the abundances of deuterium have not evolved significantly since their production about 13.8 billion years ago.[12] Measurements of Milky Way galactic deuterium from ultraviolet spectral analysis show a ratio of as much as 23 atoms of deuterium per million hydrogen atoms in undisturbed gas clouds, which is only 15% below the WMAP estimated primordial ratio of about 27 atoms per million from the Big Bang. This has been interpreted to mean that less deuterium has been destroyed in star formation in our galaxy than expected, or perhaps deuterium has been replenished by a large in-fall of primordial hydrogen from outside the galaxy.[13] In space a few hundred light years from the Sun, deuterium abundance is only 15 atoms per million, but this value is presumably influenced by differential adsorption of deuterium onto carbon dust grains in interstellar space.[14]
The abundance of deuterium in the atmosphere of Jupiter has been directly measured by the Galileo space probe as 26 atoms per million hydrogen atoms. ISO-SWS observations find 22 atoms per million hydrogen atoms in Jupiter.[15] and this abundance is thought to represent close to the primordial solar system ratio.[5] This is about 17% of the terrestrial deuterium-to-hydrogen ratio of 156 deuterium atoms per million hydrogen atoms.
Cometary bodies such as Comet Hale-Bopp and Halley’s Comet have been measured to contain relatively more deuterium (about 200 atoms D per million hydrogens), ratios which are enriched with respect to the presumed protosolar nebula ratio, probably due to heating, and which are similar to the ratios found in Earth seawater. The recent measurement of deuterium amounts of 161 atoms D per million hydrogen in Comet 103P/Hartley (a former Kuiper belt object), a ratio almost exactly that in Earth’s oceans, emphasizes the theory that Earth’s surface water may be largely comet-derived.[4][5] Most recently the deuterium–protium (D–H) ratio of 67P/Churyumov–Gerasimenko as measured by Rosetta is about three times that of Earth water, a figure that is high.[6] This has caused renewed interest in suggestions that Earth’s water may be partly of asteroidal origin.
Deuterium has also been observed to be concentrated over the mean solar abundance in other terrestrial planets, in particular Mars and Venus.[16]
Production[edit]
Deuterium is produced for industrial, scientific and military purposes, by starting with ordinary water—a small fraction of which is naturally-occurring heavy water—and then separating out the heavy water by the Girdler sulfide process, distillation, or other methods.
In theory, deuterium for heavy water could be created in a nuclear reactor, but separation from ordinary water is the cheapest bulk production process.
The world’s leading supplier of deuterium was Atomic Energy of Canada Limited until 1997, when the last heavy water plant was shut down. Canada uses heavy water as a neutron moderator for the operation of the CANDU reactor design.
Another major producer of heavy water is India. All but one of India’s atomic energy plants are pressurised heavy water plants, which use natural (i.e., not enriched) uranium. India has eight heavy water plants, of which seven are in operation. Six plants, of which five are in operation, are based on D–H exchange in ammonia gas. The other two plants extract deuterium from natural water in a process that uses hydrogen sulphide gas at high pressure.
While India is self-sufficient in heavy water for its own use, India now also exports reactor-grade heavy water.
Properties[edit]
Data for molecular deuterium[edit]
Formula: D2 or 2
1H
2
- Density: 0.180 kg/m3 at STP (0 °C, 101.325 kPa).
- Atomic weight: 2.0141017926 Da.
- Mean abundance in ocean water (from VSMOW) 155.76 ± 0.1 ppm (a ratio of 1 part per approximately 6420 parts), that is, about 0.015% of the atoms in a sample (by number, not weight)
Data at approximately 18 K for D2 (triple point):
- Density:
- Liquid: 162.4 kg/m3
- Gas: 0.452 kg/m3
- Viscosity: 12.6 μPa·s at 300 K (gas phase)
- Specific heat capacity at constant pressure cp:
- Solid: 2950 J/(kg·K)
- Gas: 5200 J/(kg·K)
Physical properties[edit]
Compared to hydrogen in its natural composition on Earth, pure deuterium (D2) has a higher melting point (18.72 K vs. 13.99 K), a higher boiling point (23.64 K vs. 20.27 K), a higher critical temperature (38.3 K vs. 32.94 K) and a higher critical pressure (1.6496 MPa vs. 1.2858 MPa).[17]
The physical properties of deuterium compounds can exhibit significant kinetic isotope effects and other physical and chemical property differences from the protium analogs. D2O, for example, is more viscous than H2O.[18] Chemically, there are differences in bond energy and length for compounds of heavy hydrogen isotopes compared to protium, which are larger than the isotopic differences in any other element. Bonds involving deuterium and tritium are somewhat stronger than the corresponding bonds in protium, and these differences are enough to cause significant changes in biological reactions. Pharmaceutical firms are interested in the fact that deuterium is harder to remove from carbon than protium.[19]
Deuterium can replace protium in water molecules to form heavy water (D2O), which is about 10.6% denser than normal water (so that ice made from it sinks in ordinary water). Heavy water is slightly toxic in eukaryotic animals, with 25% substitution of the body water causing cell division problems and sterility, and 50% substitution causing death by cytotoxic syndrome (bone marrow failure and gastrointestinal lining failure). Prokaryotic organisms, however, can survive and grow in pure heavy water, though they develop slowly.[20] Despite this toxicity, consumption of heavy water under normal circumstances does not pose a health threat to humans. It is estimated that a 70 kg (154 lb) person might drink 4.8 litres (1.3 US gal) of heavy water without serious consequences.[21] Small doses of heavy water (a few grams in humans, containing an amount of deuterium comparable to that normally present in the body) are routinely used as harmless metabolic tracers in humans and animals.
Quantum properties[edit]
The deuteron has spin +1 («triplet state») and is thus a boson. The NMR frequency of deuterium is significantly different from common light hydrogen. Infrared spectroscopy also easily differentiates many deuterated compounds, due to the large difference in IR absorption frequency seen in the vibration of a chemical bond containing deuterium, versus light hydrogen. The two stable isotopes of hydrogen can also be distinguished by using mass spectrometry.
The triplet deuteron nucleon is barely bound at EB = 2.23 MeV, and none of the higher energy states are bound. The singlet deuteron is a virtual state, with a negative binding energy of ~60 keV. There is no such stable particle, but this virtual particle transiently exists during neutron-proton inelastic scattering, accounting for the unusually large neutron scattering cross-section of the proton.[22]
Nuclear properties (the deuteron)[edit]
Deuteron mass and radius[edit]
The nucleus of deuterium is called a deuteron. It has a mass of 2.013553212745(40) Da (just over 1.875 GeV).[23][24]
The charge radius of the deuteron is 2.12799(74) fm.[25]
Like the proton radius, measurements using muonic deuterium produce a smaller result: 2.12562(78) fm.[26]
Spin and energy[edit]
Deuterium is one of only five stable nuclides with an odd number of protons and an odd number of neutrons. (2
H
, 6
Li
, 10
B
, 14
N
, 180m
Ta
; also, the long-lived radioactive nuclides 40
K
, 50
V
, 138
La
, 176
Lu
occur naturally.) Most odd-odd nuclei are unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects. Deuterium, however, benefits from having its proton and neutron coupled to a spin-1 state, which gives a stronger nuclear attraction; the corresponding spin-1 state does not exist in the two-neutron or two-proton system, due to the Pauli exclusion principle which would require one or the other identical particle with the same spin to have some other different quantum number, such as orbital angular momentum. But orbital angular momentum of either particle gives a lower binding energy for the system, primarily due to increasing distance of the particles in the steep gradient of the nuclear force. In both cases, this causes the diproton and dineutron nucleus to be unstable.
The proton and neutron making up deuterium can be dissociated through neutral current interactions with neutrinos. The cross section for this interaction is comparatively large, and deuterium was successfully used as a neutrino target in the Sudbury Neutrino Observatory experiment.
Diatomic deuterium (D2) has ortho and para nuclear spin isomers like diatomic hydrogen, but with differences in the number and population of spin states and rotational levels, which occur because the deuteron is a boson with nuclear spin equal to one.[27]
Isospin singlet state of the deuteron[edit]
Due to the similarity in mass and nuclear properties between the proton and neutron, they are sometimes considered as two symmetric types of the same object, a nucleon. While only the proton has an electric charge, this is often negligible due to the weakness of the electromagnetic interaction relative to the strong nuclear interaction. The symmetry relating the proton and neutron is known as isospin and denoted I (or sometimes T).
Isospin is an SU(2) symmetry, like ordinary spin, so is completely analogous to it. The proton and neutron, each of which have isospin-1⁄2, form an isospin doublet (analogous to a spin doublet), with a «down» state (↓) being a neutron and an «up» state (↑) being a proton.[citation needed] A pair of nucleons can either be in an antisymmetric state of isospin called singlet, or in a symmetric state called triplet. In terms of the «down» state and «up» state, the singlet is
, which can also be written :
This is a nucleus with one proton and one neutron, i.e. a deuterium nucleus. The triplet is
and thus consists of three types of nuclei, which are supposed to be symmetric: a deuterium nucleus (actually a highly excited state of it), a nucleus with two protons, and a nucleus with two neutrons. These states are not stable.
Approximated wavefunction of the deuteron[edit]
The deuteron wavefunction must be antisymmetric if the isospin representation is used (since a proton and a neutron are not identical particles, the wavefunction
need not be antisymmetric in general). Apart from their isospin, the two nucleons also have spin and spatial distributions of their wavefunction. The latter is symmetric if the deuteron is symmetric under parity (i.e. have an «even» or «positive» parity), and antisymmetric if the deuteron is antisymmetric under parity (i.e. have an «odd» or «negative» parity). The parity is fully determined by the total orbital angular momentum of the two nucleons: if it is even then the parity is even (positive), and if it is odd then the parity is odd (negative).
The deuteron, being an isospin singlet, is antisymmetric under nucleons exchange due to isospin, and therefore must be symmetric under the double exchange of their spin and location. Therefore, it can be in either of the following two different states:
- Symmetric spin and symmetric under parity. In this case, the exchange of the two nucleons will multiply the deuterium wavefunction by (−1) from isospin exchange, (+1) from spin exchange and (+1) from parity (location exchange), for a total of (−1) as needed for antisymmetry.
- Antisymmetric spin and antisymmetric under parity. In this case, the exchange of the two nucleons will multiply the deuterium wavefunction by (−1) from isospin exchange, (−1) from spin exchange and (−1) from parity (location exchange), again for a total of (−1) as needed for antisymmetry.
In the first case the deuteron is a spin triplet, so that its total spin s is 1. It also has an even parity and therefore even orbital angular momentum l ; The lower its orbital angular momentum, the lower its energy. Therefore, the lowest possible energy state has s = 1, l = 0.
In the second case the deuteron is a spin singlet, so that its total spin s is 0. It also has an odd parity and therefore odd orbital angular momentum l. Therefore, the lowest possible energy state has s = 0, l = 1.
Since s = 1 gives a stronger nuclear attraction, the deuterium ground state is in the s = 1, l = 0 state.
The same considerations lead to the possible states of an isospin triplet having s = 0, l = even or s = 1, l = odd. Thus the state of lowest energy has s = 1, l = 1, higher than that of the isospin singlet.
The analysis just given is in fact only approximate, both because isospin is not an exact symmetry, and more importantly because the strong nuclear interaction between the two nucleons is related to angular momentum in spin–orbit interaction that mixes different s and l states. That is, s and l are not constant in time (they do not commute with the Hamiltonian), and over time a state such as s = 1, l = 0 may become a state of s = 1, l = 2. Parity is still constant in time so these do not mix with odd l states (such as s = 0, l = 1). Therefore, the quantum state of the deuterium is a superposition (a linear combination) of the s = 1, l = 0 state and the s = 1, l = 2 state, even though the first component is much bigger. Since the total angular momentum j is also a good quantum number (it is a constant in time), both components must have the same j, and therefore j = 1. This is the total spin of the deuterium nucleus.
To summarize, the deuterium nucleus is antisymmetric in terms of isospin, and has spin 1 and even (+1) parity. The relative angular momentum of its nucleons l is not well defined, and the deuteron is a superposition of mostly l = 0 with some l = 2.
Magnetic and electric multipoles[edit]
In order to find theoretically the deuterium magnetic dipole moment μ, one uses the formula for a nuclear magnetic moment
with
g(l) and g(s) are g-factors of the nucleons.
Since the proton and neutron have different values for g(l) and g(s), one must separate their contributions. Each gets half of the deuterium orbital angular momentum 

where subscripts p and n stand for the proton and neutron, and g(l)n = 0.
By using the same identities as here and using the value g(l)p = 1, we arrive at the following result, in units of the nuclear magneton μN
For the s = 1, l = 0 state (j = 1), we obtain
For the s = 1, l = 2 state (j = 1), we obtain
The measured value of the deuterium magnetic dipole moment, is 0.857 μN, which is 97.5% of the 0.879 μN value obtained by simply adding moments of the proton and neutron. This suggests that the state of the deuterium is indeed to a good approximation s = 1, l = 0 state, which occurs with both nucleons spinning in the same direction, but their magnetic moments subtracting because of the neutron’s negative moment.
But the slightly lower experimental number than that which results from simple addition of proton and (negative) neutron moments shows that deuterium is actually a linear combination of mostly s = 1, l = 0 state with a slight admixture of s = 1, l = 2 state.
The electric dipole is zero as usual.
The measured electric quadrupole of the deuterium is 0.2859 e·fm2. While the order of magnitude is reasonable, since the deuterium radius is of order of 1 femtometer (see below) and its electric charge is e, the above model does not suffice for its computation. More specifically, the electric quadrupole does not get a contribution from the l =0 state (which is the dominant one) and does get a contribution from a term mixing the l =0 and the l =2 states, because the electric quadrupole operator does not commute with angular momentum.
The latter contribution is dominant in the absence of a pure l = 0 contribution, but cannot be calculated without knowing the exact spatial form of the nucleons wavefunction inside the deuterium.
Higher magnetic and electric multipole moments cannot be calculated by the above model, for similar reasons.
Applications[edit]
Deuterium has a number of commercial and scientific uses. These include:
Nuclear reactors[edit]
Ionized deuterium in a fusor reactor giving off its characteristic pinkish-red glow
Deuterium is used in heavy water moderated fission reactors, usually as liquid D2O, to slow neutrons without the high neutron absorption of ordinary hydrogen.[28] This is a common commercial use for larger amounts of deuterium.
In research reactors, liquid D2 is used in cold sources to moderate neutrons to very low energies and wavelengths appropriate for scattering experiments.
Experimentally, deuterium is the most common nuclide used in nuclear fusion reactor designs, especially in combination with tritium, because of the large reaction rate (or nuclear cross section) and high energy yield of the D–T reaction. There is an even higher-yield D–3
He
fusion reaction, though the breakeven point of D–3
He
is higher than that of most other fusion reactions; together with the scarcity of 3
He
, this makes it implausible as a practical power source until at least D–T and D–D fusion reactions have been performed on a commercial scale. Commercial nuclear fusion is not yet an accomplished technology.
NMR spectroscopy[edit]

Deuterium is most commonly used in hydrogen nuclear magnetic resonance spectroscopy (proton NMR) in the following way. NMR ordinarily requires compounds of interest to be analyzed as dissolved in solution. Because of deuterium’s nuclear spin properties which differ from the light hydrogen usually present in organic molecules, NMR spectra of hydrogen/protium are highly differentiable from that of deuterium, and in practice deuterium is not «seen» by an NMR instrument tuned for light-hydrogen. Deuterated solvents (including heavy water, but also compounds like deuterated chloroform, CDCl3) are therefore routinely used in NMR spectroscopy, in order to allow only the light-hydrogen spectra of the compound of interest to be measured, without solvent-signal interference.
Nuclear magnetic resonance spectroscopy can also be used to obtain information about the deuteron’s environment in isotopically labelled samples (Deuterium NMR). For example, the configuration of hydrocarbon chains in lipid bilayers can be quantified using solid state deuterium NMR with deuterium-labelled lipid molecules.[29]
Deuterium NMR spectra are especially informative in the solid state because of its relatively small quadrupole moment in comparison with those of bigger quadrupolar nuclei such as chlorine-35, for example.
Tracing[edit]
In chemistry, biochemistry and environmental sciences, deuterium is used as a non-radioactive, stable isotopic tracer, for example, in the doubly labeled water test. In chemical reactions and metabolic pathways, deuterium behaves somewhat similarly to ordinary hydrogen (with a few chemical differences, as noted). It can be distinguished from ordinary hydrogen most easily by its mass, using mass spectrometry or infrared spectrometry. Deuterium can be detected by femtosecond infrared spectroscopy, since the mass difference drastically affects the frequency of molecular vibrations; deuterium-carbon bond vibrations are found in spectral regions free of other signals.
Measurements of small variations in the natural abundances of deuterium, along with those of the stable heavy oxygen isotopes 17O and 18O, are of importance in hydrology, to trace the geographic origin of Earth’s waters. The heavy isotopes of hydrogen and oxygen in rainwater (so-called meteoric water) are enriched as a function of the environmental temperature of the region in which the precipitation falls (and thus enrichment is related to mean latitude). The relative enrichment of the heavy isotopes in rainwater (as referenced to mean ocean water), when plotted against temperature falls predictably along a line called the global meteoric water line (GMWL). This plot allows samples of precipitation-originated water to be identified along with general information about the climate in which it originated. Evaporative and other processes in bodies of water, and also ground water processes, also differentially alter the ratios of heavy hydrogen and oxygen isotopes in fresh and salt waters, in characteristic and often regionally distinctive ways.[30] The ratio of concentration of 2H to 1H is usually indicated with a delta as δ2H and the geographic patterns of these values are plotted in maps termed as isoscapes. Stable isotopes are incorporated into plants and animals and an analysis of the ratios in a migrant bird or insect can help suggest a rough guide to their origins.[31][32]
Contrast properties[edit]
Neutron scattering techniques particularly profit from availability of deuterated samples: The H and D cross sections are very distinct and different in sign, which allows contrast variation in such experiments. Further, a nuisance problem of ordinary hydrogen is its large incoherent neutron cross section, which is nil for D. The substitution of deuterium atoms for hydrogen atoms thus reduces scattering noise.
Hydrogen is an important and major component in all materials of organic chemistry and life science, but it barely interacts with X-rays. As hydrogen (and deuterium) interact strongly with neutrons, neutron scattering techniques, together with a modern deuteration facility,[33] fills a niche in many studies of macromolecules in biology and many other areas.
Nuclear weapons[edit]
This is discussed below. It is notable that although most stars, including the Sun, generate energy over most of their lives by fusing hydrogen into heavier elements, such fusion of light hydrogen (protium) has never been successful in the conditions attainable on Earth. Thus, all artificial fusion, including the hydrogen fusion that occurs in so-called hydrogen bombs, requires heavy hydrogen (either tritium or deuterium, or both) in order for the process to work.
Drugs[edit]
A deuterated drug is a small molecule medicinal product in which one or more of the hydrogen atoms contained in the drug molecule have been replaced by deuterium. Because of the kinetic isotope effect, deuterium-containing drugs may have significantly lower rates of metabolism, and hence a longer half-life.[34][35][36] In 2017, deutetrabenazine became the first deuterated drug to receive FDA approval.[37]
Reinforced essential nutrients[edit]
Deuterium can be used to reinforce specific oxidation-vulnerable C-H bonds within essential or conditionally essential nutrients,[38] such as certain amino acids, or polyunsaturated fatty acids (PUFA), making them more resistant to oxidative damage. Deuterated polyunsaturated fatty acids, such as linoleic acid, slow down the chain reaction of lipid peroxidation that damage living cells.[39][40] Deuterated ethyl ester of linoleic acid (RT001), developed by Retrotope, is in a compassionate use trial in infantile neuroaxonal dystrophy and has successfully completed a Phase I/II trial in Friedreich’s ataxia.[41][37]
Thermostabilization[edit]
Live vaccines, such as the oral poliovirus vaccine, can be stabilized by deuterium, either alone or in combination with other stabilizers such as MgCl2.[42]
Slowing circadian oscillations[edit]
Deuterium has been shown to lengthen the period of oscillation of the circadian clock when dosed in rats, hamsters, and Gonyaulax dinoflagellates.[43][44][45][46] In rats, chronic intake of 25% D2O disrupts circadian rhythmicity by lengthening the circadian period of suprachiasmatic nucleus-dependent rhythms in the brain’s hypothalamus.[45] Experiments in hamsters also support the theory that deuterium acts directly on the suprachiasmatic nucleus to lengthen the free-running circadian period.[47]
History[edit]
Suspicion of lighter element isotopes[edit]
The existence of nonradioactive isotopes of lighter elements had been suspected in studies of neon as early as 1913, and proven by mass spectrometry of light elements in 1920. At that time the neutron had not yet been discovered, and the prevailing theory was that isotopes of an element differ by the existence of additional protons in the nucleus accompanied by an equal number of nuclear electrons. In this theory, the deuterium nucleus with mass two and charge one would contain two protons and one nuclear electron. However, it was expected that the element hydrogen with a measured average atomic mass very close to 1 Da, the known mass of the proton, always has a nucleus composed of a single proton (a known particle), and could not contain a second proton. Thus, hydrogen was thought to have no heavy isotopes.
Deuterium detected[edit]

It was first detected spectroscopically in late 1931 by Harold Urey, a chemist at Columbia University. Urey’s collaborator, Ferdinand Brickwedde, distilled five liters of cryogenically produced liquid hydrogen to 1 mL of liquid, using the low-temperature physics laboratory that had recently been established at the National Bureau of Standards in Washington, D.C. (now the National Institute of Standards and Technology). The technique had previously been used to isolate heavy isotopes of neon. The cryogenic boiloff technique concentrated the fraction of the mass-2 isotope of hydrogen to a degree that made its spectroscopic identification unambiguous.[48][49]
Naming of the isotope and Nobel Prize[edit]
Urey created the names protium, deuterium, and tritium in an article published in 1934. The name is based in part on advice from G. N. Lewis who had proposed the name «deutium». The name is derived from the Greek deuteros (‘second’), and the nucleus to be called «deuteron» or «deuton». Isotopes and new elements were traditionally given the name that their discoverer decided. Some British scientists, such as Ernest Rutherford, wanted the isotope to be called «diplogen», from the Greek diploos (‘double’), and the nucleus to be called «diplon».[3][50]
The amount inferred for normal abundance of this heavy isotope of hydrogen was so small (only about 1 atom in 6400 hydrogen atoms in ocean water (156 deuteriums per million hydrogens)) that it had not noticeably affected previous measurements of (average) hydrogen atomic mass. This explained why it hadn’t been experimentally suspected before. Urey was able to concentrate water to show partial enrichment of deuterium. Lewis had prepared the first samples of pure heavy water in 1933. The discovery of deuterium, coming before the discovery of the neutron in 1932, was an experimental shock to theory, but when the neutron was reported, making deuterium’s existence more explainable, deuterium won Urey the Nobel Prize in Chemistry in 1934. Lewis was embittered by being passed over for this recognition given to his former student.[3]
«Heavy water» experiments in World War II[edit]
Shortly before the war, Hans von Halban and Lew Kowarski moved their research on neutron moderation from France to Britain, smuggling the entire global supply of heavy water (which had been made in Norway) across in twenty-six steel drums.[51][52]
During World War II, Nazi Germany was known to be conducting experiments using heavy water as moderator for a nuclear reactor design. Such experiments were a source of concern because they might allow them to produce plutonium for an atomic bomb. Ultimately it led to the Allied operation called the «Norwegian heavy water sabotage», the purpose of which was to destroy the Vemork deuterium production/enrichment facility in Norway. At the time this was considered important to the potential progress of the war.
After World War II ended, the Allies discovered that Germany was not putting as much serious effort into the program as had been previously thought. The Germans had completed only a small, partly built experimental reactor (which had been hidden away) and had been unable to sustain a chain reaction. By the end of the war, the Germans did not even have a fifth of the amount of heavy water needed to run the reactor,[clarification needed] partially due to the Norwegian heavy water sabotage operation. However, even if the Germans had succeeded in getting a reactor operational (as the U.S. did with Chicago Pile-1 in late 1942), they would still have been at least several years away from the development of an atomic bomb. The engineering process, even with maximal effort and funding, required about two and a half years (from first critical reactor to bomb) in both the U.S. and U.S.S.R., for example.
In thermonuclear weapons[edit]

The «Sausage» device casing of the Ivy Mike H bomb, attached to instrumentation and cryogenic equipment. The 20-ft-tall bomb held a cryogenic Dewar flask with room for 160 kg of liquid deuterium.
The 62-ton Ivy Mike device built by the United States and exploded on 1 November 1952, was the first fully successful «hydrogen bomb» (thermonuclear bomb). In this context, it was the first bomb in which most of the energy released came from nuclear reaction stages that followed the primary nuclear fission stage of the atomic bomb. The Ivy Mike bomb was a factory-like building, rather than a deliverable weapon. At its center, a very large cylindrical, insulated vacuum flask or cryostat, held cryogenic liquid deuterium in a volume of about 1000 liters (160 kilograms in mass, if this volume had been completely filled). Then, a conventional atomic bomb (the «primary») at one end of the bomb was used to create the conditions of extreme temperature and pressure that were needed to set off the thermonuclear reaction.
Within a few years, so-called «dry» hydrogen bombs were developed that did not need cryogenic hydrogen. Released information suggests that all thermonuclear weapons built since then contain chemical compounds of deuterium and lithium in their secondary stages. The material that contains the deuterium is mostly lithium deuteride, with the lithium consisting of the isotope lithium-6. When the lithium-6 is bombarded with fast neutrons from the atomic bomb, tritium (hydrogen-3) is produced, and then the deuterium and the tritium quickly engage in thermonuclear fusion, releasing abundant energy, helium-4, and even more free neutrons. «Pure» fusion weapons such as the Tsar Bomba are believed to be obsolete. In most modern («boosted») thermonuclear weapons, fusion directly provides only a small fraction of the total energy. Fission of a natural uranium U-238 tamper by fast neutrons produced from D-T fusion accounts for a much larger (i.e. boosted) energy release than the fusion reaction itself.
Modern research[edit]
In August 2018, scientists announced the transformation of gaseous deuterium into a liquid metallic form. This may help researchers better understand giant gas planets, such as Jupiter, Saturn and related exoplanets, since such planets are thought to contain a large quantity of liquid metallic hydrogen, which may be responsible for their observed powerful magnetic fields.[53][54]
Antideuterium[edit]
An antideuteron is the antimatter counterpart of the nucleus of deuterium, consisting of an antiproton and an antineutron. The antideuteron was first produced in 1965 at the Proton Synchrotron at CERN[55] and the Alternating Gradient Synchrotron at Brookhaven National Laboratory.[56] A complete atom, with a positron orbiting the nucleus, would be called antideuterium, but as of 2019 antideuterium has not yet been created. The proposed symbol for antideuterium is
D
, that is, D with an overbar.[57]
See also[edit]
- Isotopes of hydrogen
- Nuclear fusion
- Tokamak
- Tritium
- Heavy water
References[edit]
- ^ Hagemann R, Nief G, Roth E (1970). «Absolute isotopic scale for deuterium analysis of natural waters. Absolute D/H ratio for SMOW 1». Tellus. 22 (6): 712–715. doi:10.1111/j.2153-3490.1970.tb00540.x.
- ^ Wang, M.; Audi, G.; Kondev, F. G.; Huang, W. J.; Naimi, S.; Xu, X. (2017). «The AME2016 atomic mass evaluation (II). Tables, graphs, and references» (PDF). Chinese Physics C. 41 (3): 030003-1–030003-442. doi:10.1088/1674-1137/41/3/030003.
- ^ a b c O’Leary D (February 2012). «The deeds to deuterium». Nature Chemistry. 4 (3): 236. Bibcode:2012NatCh…4..236O. doi:10.1038/nchem.1273. PMID 22354440.
- ^ a b Hartogh P, Lis DC, Bockelée-Morvan D, de Val-Borro M, Biver N, Küppers M, et al. (October 2011). «Ocean-like water in the Jupiter-family comet 103P/Hartley 2». Nature. 478 (7368): 218–220. Bibcode:2011Natur.478..218H. doi:10.1038/nature10519. PMID 21976024. S2CID 3139621.
- ^ a b c Hersant F, Gautier D, Hure J (2001). «A two-dimensional model for the primordial nebula constrained by D/H measurements in the Solar system: Implications for the formation of giant planets». The Astrophysical Journal. 554 (1): 391–407. Bibcode:2001ApJ…554..391H. doi:10.1086/321355. — see fig. 7. for a review of D/H ratios in various astronomical objects
- ^ a b Altwegg K, Balsiger H, Bar-Nun A, Berthelier JJ, Bieler A, Bochsler P, et al. (January 2015). «Cometary science. 67P/Churyumov–Gerasimenko, a Jupiter family comet with a high D/H ratio» (PDF). Science. 347 (6220): 1261952. Bibcode:2015Sci…347A.387A. doi:10.1126/science.1261952. PMID 25501976. S2CID 206563296.
- ^ «Provisional Recommendations». Nomenclature of Inorganic Chemistry. Chemical Nomenclature and Structure Representation Division. IUPAC. § IR-3.3.2. Archived from the original on 27 October 2006. Retrieved 3 October 2007.
- ^ Hébrard G, Péquignot D, Vidal-Madjar A, Walsh JR, Ferlet R (7 February 2000). «Detection of deuterium Balmer lines in the Orion Nebula». Astronomy and Astrophysics. 354: L79. arXiv:astro-ph/0002141. Bibcode:2000A&A…354L..79H.
- ^ «Water absorption spectrum». London South Bank University (lsbu.ac.uk). London, UK. Archived from the original on 27 July 2017.
- ^ Weiss A. «Equilibrium and change: The physics behind Big Bang nucleosynthesis». Einstein Online. Archived from the original on 8 February 2007. Retrieved 24 February 2007.
- ^ IUPAC Commission on Nomenclature of Inorganic Chemistry (2001). «Names for muonium and hydrogen atoms and their ions» (PDF). Pure and Applied Chemistry. 73 (2): 377–380. doi:10.1351/pac200173020377. S2CID 97138983. Archived (PDF) from the original on 25 April 2003.
- ^ «Cosmic Detectives». The European Space Agency (ESA). 2 April 2013. Retrieved 15 April 2013.
- ^ «FUSE Satellite solves the case of the missing deuterium» (Press release). NASA.
- ^ «Graph of deuterium with distance in our galactic neighborhood». FUSE Satellite project. Baltimore, MD: Johns Hopkins University. Archived from the original on 5 December 2013.
- See also
Linsky JL, Draine BT, Moos HW, Jenkins EB, Wood BE, Oliveira C, et al. (2006). «What is the Total Deuterium Abundance in the Local Galactic Disk?». The Astrophysical Journal. 647 (2): 1106–1124. arXiv:astro-ph/0608308. Bibcode:2006ApJ…647.1106L. doi:10.1086/505556. S2CID 14461382.
- ^ Lellouch E, Bézard B, Fouchet T, Feuchtgruber H, Encrenaz T, de Graauw T (2001). «The deuterium abundance in Jupiter and Saturn from ISO-SWS observations» (PDF). Astronomy & Astrophysics. 670 (2): 610–622. Bibcode:2001A&A…370..610L. doi:10.1051/0004-6361:20010259.
- ^ Hunten DM (1993). «Atmospheric evolution of the terrestrial planets». Science. 259 (5097): 915–920. Bibcode:1993Sci…259..915H. doi:10.1126/science.259.5097.915. ISSN 0036-8075. JSTOR 2880608. S2CID 178360068.
- ^ «Deuterium, 2H». PubChem. compounds. U.S. National Institutes of Health.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Halford B (4 July 2016). «The deuterium switcheroo». Chemical & Engineering News. American Chemical Society. pp. 32–36.
- ^ Kushner DJ, Baker A, Dunstall TG (February 1999). «Pharmacological uses and perspectives of heavy water and deuterated compounds». Canadian Journal of Physiology and Pharmacology. 77 (2): 79–88. doi:10.1139/cjpp-77-2-79. PMID 10535697.
- ^ Vertes, Attila, ed. (2003). «Physiological effect of heavy water». Elements and isotopes: formation, transformation, distribution. Dordrecht: Kluwer. pp. 111–112. ISBN 978-1-4020-1314-0.
- ^ «Neutron-proton scattering» (PDF). mightylib.mit.edu (course notes). Massachusetts Institute of Technology. Fall 2004. 22.101. Archived from the original (PDF) on 21 July 2011. Retrieved 23 November 2011.
- ^ «Deuteron mass in u». Physics.nist.gov. U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ «Deuteron mass energy equivalent in MeV». Physics.nist.gov. U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ «Deuteron RMS charge radius Physics.nist.gov». U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ Pohl R, Nez F, Fernandes LM, Amaro FD, Biraben F, Cardoso JM, et al. (The CREMA Collaboration) (August 2016). «Laser spectroscopy of muonic deuterium». Science. 353 (6300): 669–673. Bibcode:2016Sci…353..669P. doi:10.1126/science.aaf2468. hdl:10316/80061. PMID 27516595. S2CID 206647315.
- ^ Hollas JM (1996). Modern Spectroscopy (3rd ed.). John Wiley and Sons. p. 115. ISBN 0-471-96523-5.
- ^ See neutron cross section#Typical cross sections
- ^ Seelig J (October 1971). «On the flexibility of hydrocarbon chains in lipid bilayers». Journal of the American Chemical Society. 93 (20): 5017–5022. doi:10.1021/ja00749a006. PMID 4332660.
- ^ «Oxygen – Isotopes and Hydrology». SAHRA. Archived from the original on 2 January 2007. Retrieved 10 September 2007.
- ^ West JB (2009). Isoscapes: Understanding movement, pattern, and process on Earth through isotope mapping. Springer.
- ^ Hobson KA, Van Wilgenburg SL, Wassenaar LI, Larson K (2012). «Linking hydrogen (δ2H) isotopes in feathers and precipitation: Sources of variance and consequences for assignment to isoscapes». PLOS ONE. 7 (4): e35137. Bibcode:2012PLoSO…735137H. doi:10.1371/journal.pone.0035137. PMC 3324428. PMID 22509393.
- ^ «Deuteration». nmi3.eu. Integrated Infrastructure Initiative for Neutron Scattering and Muon Spectroscopy (NMI3). Archived from the original on 3 February 2019. Retrieved 23 January 2012.
- ^ Sanderson K (March 2009). «Big interest in heavy drugs». Nature. 458 (7236): 269. doi:10.1038/458269a. PMID 19295573. S2CID 4343676.
- ^ Katsnelson A (June 2013). «Heavy drugs draw heavy interest from pharma backers». Nature Medicine. 19 (6): 656. doi:10.1038/nm0613-656. PMID 23744136. S2CID 29789127.
- ^ Gant TG (May 2014). «Using deuterium in drug discovery: Leaving the label in the drug». Journal of Medicinal Chemistry. 57 (9): 3595–3611. doi:10.1021/jm4007998. PMID 24294889.
- ^ a b Schmidt C (June 2017). «First deuterated drug approved». Nature Biotechnology. 35 (6): 493–494. doi:10.1038/nbt0617-493. PMID 28591114. S2CID 205269152.
- ^ Demidov VV (September 2007). «Heavy isotopes to avert ageing?». Trends in Biotechnology. 25 (9): 371–375. doi:10.1016/j.tibtech.2007.07.007. PMID 17681625.
- ^ Halliwell, Barry; Gutteridge, John M.C. (2015). Free Radical Biology and Medicine (5th ed.). Oxford: Clarendon Press. ISBN 9780198717485.
- ^ Hill S, Lamberson CR, Xu L, To R, Tsui HS, Shmanai VV, et al. (August 2012). «Small amounts of isotope-reinforced polyunsaturated fatty acids suppress lipid autoxidation». Free Radical Biology & Medicine. 53 (4): 893–906. doi:10.1016/j.freeradbiomed.2012.06.004. PMC 3437768. PMID 22705367.
- ^ «A Randomized, Double-blind, Controlled Study to Assess the Safety, Tolerability, and Pharmacokinetics of RT001 in Patients with Friedreich’s Ataxia». 24 November 2020.
- ^ Wu R, Georgescu MM, Delpeyroux F, Guillot S, Balanant J, Simpson K, Crainic R (August 1995). «Thermostabilization of live virus vaccines by heavy water (D2O)». Vaccine. 13 (12): 1058–1063. doi:10.1016/0264-410X(95)00068-C. PMID 7491812.
- ^ Lesauter J, Silver R (September 1993). «Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts». Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. ISSN 0031-9384. PMID 8415956. S2CID 32466816.
- ^ McDaniel M, Sulzman FM, Hastings JW (November 1974). «Heavy water slows the Gonyaulax clock: a test of the hypothesis that D2O affects circadian oscillations by diminishing the apparent temperature». Proceedings of the National Academy of Sciences of the United States of America. 71 (11): 4389–4391. Bibcode:1974PNAS…71.4389M. doi:10.1073/pnas.71.11.4389. PMC 433889. PMID 4530989.
- ^ a b Petersen CC, Mistlberger RE (August 2017). «Interval timing is preserved despite circadian desynchrony in rats: Constant light and heavy water studies». Journal of Biological Rhythms. 32 (4): 295–308. doi:10.1177/0748730417716231. PMID 28651478. S2CID 4633617.
- ^ Richter CP (March 1977). «Heavy water as a tool for study of the forces that control length of period of the 24-hour clock of the hamster». Proceedings of the National Academy of Sciences of the United States of America. 74 (3): 1295–1299. Bibcode:1977PNAS…74.1295R. doi:10.1073/pnas.74.3.1295. PMC 430671. PMID 265574.
- ^ Lesauter J, Silver R (September 1993). «Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts». Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. PMID 8415956. S2CID 32466816.
- ^ Brickwedde FG (1982). «Harold Urey and the discovery of deuterium». Physics Today. Vol. 35, no. 9. p. 34. Bibcode:1982PhT….35i..34B. doi:10.1063/1.2915259.
- ^ Urey H, Brickwedde F, Murphy G (1932). «A hydrogen isotope of mass 2». Physical Review. 39 (1): 164–165. Bibcode:1932PhRv…39..164U. doi:10.1103/PhysRev.39.164.
- ^ «Deuterium v. Diplogen». Science. Time. 19 February 1934. Archived from the original on 15 September 2009.
- ^ Sherriff L (1 June 2007). «Royal Society unearths top secret nuclear research». The Register. Situation Publishing Ltd. Retrieved 3 June 2007.
- ^ The battle for heavy water: Three physicists’ heroic exploits. CERN Bulletin (Report). European Organization for Nuclear Research. 25 March 2002. Retrieved 2 November 2015.
- ^ Chang K (16 August 2018). «Settling arguments about hydrogen with 168 giant lasers». The New York Times. Archived from the original on 1 January 2022. Retrieved 18 August 2018.
- ^ «Under pressure, hydrogen offers a reflection of giant planet interiors» (Press release). Carnegie Institution for Science. 15 August 2018. Retrieved 19 August 2018.
- ^ Massam T, Muller T, Righini B, Schneegans M, Zichichi A (1965). «Experimental observation of antideuteron production». Il Nuovo Cimento. 39 (1): 10–14. Bibcode:1965NCimS..39…10M. doi:10.1007/BF02814251. S2CID 122952224.
- ^ Dorfan DE, Eades J, Lederman LM, Lee W, Ting CC (June 1965). «Observation of antideuterons». Physical Review Letters. 14 (24): 1003–1006. Bibcode:1965PhRvL..14.1003D. doi:10.1103/PhysRevLett.14.1003.
- ^ Chardonnet P, Orloff J, Salati P (1997). «The production of anti-matter in our galaxy». Physics Letters B. 409 (1–4): 313–320. arXiv:astro-ph/9705110. Bibcode:1997PhLB..409..313C. doi:10.1016/S0370-2693(97)00870-8. S2CID 118919611.
External links[edit]
![]()
Look up deuterium in Wiktionary, the free dictionary.
- «Nuclear Data Center». KAERI.
- «Annotated bibliography for deuterium». ALSOS: The Digital Library for Nuclear Issues. Lexington, VA: Washington and Lee University. Archived from the original on 5 May 2010. Retrieved 26 November 2019.
- Mullins, Justin (27 April 2005). «Desktop nuclear fusion demonstrated». New Scientist.
- Lloyd, Robin (21 August 2006). «Missing gas found in Milky Way». Space.com.
 Deuterium isotope highlighted on a truncated table of nuclides for atomic numbers 1 through 29. Number of neutrons starts at zero and increases downward. Number of protons starts at one and increases rightward. Stable isotopes in blue. | |
| General | |
|---|---|
| Symbol | 2H |
| Names | Deuterium, hydrogen-2, 2 H , H-2, hydrogen-2, D, 2 H |
| Protons (Z) | 1 |
| Neutrons (N) | 1 |
| Nuclide data | |
| Natural abundance | 0.0156% (Earth)[1] |
| Isotope mass | 2.01410177811[2] Da |
| Spin | 1+ |
| Excess energy | 13135.720±0.001 keV |
| Binding energy | 2224.52±0.20 keV |
| Isotopes of hydrogen Complete table of nuclides |
Deuterium (or hydrogen-2, symbol 2
H
or D, also known as heavy hydrogen) is one of two stable isotopes of hydrogen (the other being protium, or hydrogen-1). The nucleus of a deuterium atom, called a deuteron, contains one proton and one neutron, whereas the far more common protium has no neutrons in the nucleus. Deuterium has a natural abundance in Earth’s oceans of about one atom of deuterium among all 6420 atoms of hydrogen (see heavy water). Thus deuterium accounts for approximately 0.0156% by number (0.0312% by mass) of all the naturally occurring hydrogen in the oceans, while protium accounts for more than 99.98%. The abundance of deuterium changes slightly from one kind of natural water to another (see Vienna Standard Mean Ocean Water). (Tritium is yet another hydrogen isotope with symbol 3
H
or T. It has two neutrons, and is radioactive and far more rare than deuterium.)
The name deuterium is derived from the Greek deuteros, meaning «second», to denote the two particles composing the nucleus.[3] Deuterium was discovered by American chemist Harold Urey in 1931. Urey and others produced samples of heavy water in which the deuterium content had been highly concentrated. The discovery of deuterium won Urey a Nobel Prize in 1934.
Deuterium is destroyed in the interiors of stars faster than it is produced. Other natural processes are thought to produce only an insignificant amount of deuterium. Nearly all deuterium found in nature was produced in the Big Bang 13.8 billion years ago, as the basic or primordial ratio of hydrogen-1 to deuterium (about 26 atoms of deuterium per million hydrogen atoms) has its origin from that time. This is the ratio found in the gas giant planets, such as Jupiter. The analysis of deuterium–protium ratios in comets found results very similar to the mean ratio in Earth’s oceans (156 atoms of deuterium per million hydrogen atoms). This reinforces theories that much of Earth’s ocean water is of cometary origin.[4][5] The deuterium–protium ratio of the comet 67P/Churyumov–Gerasimenko, as measured by the Rosetta space probe, is about three times that of Earth water. This figure is the highest yet measured in a comet.[6]
Deuterium–protium ratios thus continue to be an active topic of research in both astronomy and climatology.
Differences from common hydrogen (protium)[edit]
Chemical symbol[edit]

Deuterium is frequently represented by the chemical symbol D. Since it is an isotope of hydrogen with mass number 2, it is also represented by 2
H
. IUPAC allows both D and 2
H
, although 2
H
is preferred.[7] A distinct chemical symbol is used for convenience because of the isotope’s common use in various scientific processes. Also, its large mass difference with protium (1H) (deuterium has a mass of 2.014102 u, compared to the mean hydrogen atomic weight of 1.007947 u, and protium’s mass of 1.007825 u) confers non-negligible chemical dissimilarities with protium-containing compounds, whereas the isotope weight ratios within other chemical elements are largely insignificant in this regard.
Spectroscopy[edit]
In quantum mechanics the energy levels of electrons in atoms depend on the reduced mass of the system of electron and nucleus. For the hydrogen atom, the role of reduced mass is most simply seen in the Bohr model of the atom, where the reduced mass appears in a simple calculation of the Rydberg constant and Rydberg equation, but the reduced mass also appears in the Schrödinger equation, and the Dirac equation for calculating atomic energy levels.
The reduced mass of the system in these equations is close to the mass of a single electron, but differs from it by a small amount about equal to the ratio of mass of the electron to the atomic nucleus. For hydrogen, this amount is about 1837/1836, or 1.000545, and for deuterium it is even smaller: 3671/3670, or 1.0002725. The energies of spectroscopic lines for deuterium and light hydrogen (hydrogen-1) therefore differ by the ratios of these two numbers, which is 1.000272. The wavelengths of all deuterium spectroscopic lines are shorter than the corresponding lines of light hydrogen, by a factor of 1.000272. In astronomical observation, this corresponds to a blue Doppler shift of 0.000272 times the speed of light, or 81.6 km/s.[8]
The differences are much more pronounced in vibrational spectroscopy such as infrared spectroscopy and Raman spectroscopy,[9] and in rotational spectra such as microwave spectroscopy because the reduced mass of the deuterium is markedly higher than that of protium. In nuclear magnetic resonance spectroscopy, deuterium has a very different NMR frequency (e.g. 61 MHz when protium is at 400 MHz) and is much less sensitive. Deuterated solvents are usually used in protium NMR to prevent the solvent from overlapping with the signal, although deuterium NMR on its own right is also possible.
Big Bang nucleosynthesis[edit]
Deuterium is thought to have played an important role in setting the number and ratios of the elements that were formed in the Big Bang. Combining thermodynamics and the changes brought about by cosmic expansion, one can calculate the fraction of protons and neutrons based on the temperature at the point that the universe cooled enough to allow formation of nuclei. This calculation indicates seven protons for every neutron at the beginning of nucleogenesis, a ratio that would remain stable even after nucleogenesis was over. This fraction was in favor of protons initially, primarily because the lower mass of the proton favored their production. As the Universe expanded, it cooled. Free neutrons and protons are less stable than helium nuclei, and the protons and neutrons had a strong energetic reason to form helium-4. However, forming helium-4 requires the intermediate step of forming deuterium.
Through much of the few minutes after the Big Bang during which nucleosynthesis could have occurred, the temperature was high enough that the mean energy per particle was greater than the binding energy of weakly bound deuterium; therefore any deuterium that was formed was immediately destroyed. This situation is known as the deuterium bottleneck. The bottleneck delayed formation of any helium-4 until the Universe became cool enough to form deuterium (at about a temperature equivalent to 100 keV). At this point, there was a sudden burst of element formation (first deuterium, which immediately fused to helium). However, very shortly thereafter, at twenty minutes after the Big Bang, the Universe became too cool for any further nuclear fusion and nucleosynthesis to occur. At this point, the elemental abundances were nearly fixed, with the only change as some of the radioactive products of Big Bang nucleosynthesis (such as tritium) decay.[10] The deuterium bottleneck in the formation of helium, together with the lack of stable ways for helium to combine with hydrogen or with itself (there are no stable nuclei with mass numbers of five or eight) meant that an insignificant amount of carbon, or any elements heavier than carbon, formed in the Big Bang. These elements thus required formation in stars. At the same time, the failure of much nucleogenesis during the Big Bang ensured that there would be plenty of hydrogen in the later universe available to form long-lived stars, such as our Sun.
Abundance[edit]
Deuterium occurs in trace amounts naturally as deuterium gas, written 2
H
2 or D2, but most of the naturally occurring deuterium atoms in the Universe are bonded with a typical 1
H
atom to form a gas called hydrogen deuteride (HD or 1
H
2
H
).[11] Similarly, natural water contains trace amounts of deuterated molecules, almost all as semiheavy water HDO with only one deuterium atom.
The existence of deuterium on Earth, elsewhere in the Solar System (as confirmed by planetary probes), and in the spectra of stars, is also an important datum in cosmology. Gamma radiation from ordinary nuclear fusion dissociates deuterium into protons and neutrons, and there are no known natural processes other than the Big Bang nucleosynthesis that might have produced deuterium at anything close to its observed natural abundance. Deuterium is produced by the rare cluster decay, and occasional absorption of naturally occurring neutrons by light hydrogen, but these are trivial sources. There is thought to be little deuterium in the interior of the Sun and other stars, as at these temperatures the nuclear fusion reactions that consume deuterium happen much faster than the proton-proton reaction that creates deuterium. However, deuterium persists in the outer solar atmosphere at roughly the same concentration as in Jupiter, and this has probably been unchanged since the origin of the Solar System. The natural abundance of deuterium seems to be a very similar fraction of hydrogen, wherever hydrogen is found, unless there are obvious processes at work that concentrate it.
The existence of deuterium at a low but constant primordial fraction in all hydrogen is another one of the arguments in favor of the Big Bang theory over the Steady State theory of the Universe. The observed ratios of hydrogen to helium to deuterium in the universe are difficult to explain except with a Big Bang model. It is estimated that the abundances of deuterium have not evolved significantly since their production about 13.8 billion years ago.[12] Measurements of Milky Way galactic deuterium from ultraviolet spectral analysis show a ratio of as much as 23 atoms of deuterium per million hydrogen atoms in undisturbed gas clouds, which is only 15% below the WMAP estimated primordial ratio of about 27 atoms per million from the Big Bang. This has been interpreted to mean that less deuterium has been destroyed in star formation in our galaxy than expected, or perhaps deuterium has been replenished by a large in-fall of primordial hydrogen from outside the galaxy.[13] In space a few hundred light years from the Sun, deuterium abundance is only 15 atoms per million, but this value is presumably influenced by differential adsorption of deuterium onto carbon dust grains in interstellar space.[14]
The abundance of deuterium in the atmosphere of Jupiter has been directly measured by the Galileo space probe as 26 atoms per million hydrogen atoms. ISO-SWS observations find 22 atoms per million hydrogen atoms in Jupiter.[15] and this abundance is thought to represent close to the primordial solar system ratio.[5] This is about 17% of the terrestrial deuterium-to-hydrogen ratio of 156 deuterium atoms per million hydrogen atoms.
Cometary bodies such as Comet Hale-Bopp and Halley’s Comet have been measured to contain relatively more deuterium (about 200 atoms D per million hydrogens), ratios which are enriched with respect to the presumed protosolar nebula ratio, probably due to heating, and which are similar to the ratios found in Earth seawater. The recent measurement of deuterium amounts of 161 atoms D per million hydrogen in Comet 103P/Hartley (a former Kuiper belt object), a ratio almost exactly that in Earth’s oceans, emphasizes the theory that Earth’s surface water may be largely comet-derived.[4][5] Most recently the deuterium–protium (D–H) ratio of 67P/Churyumov–Gerasimenko as measured by Rosetta is about three times that of Earth water, a figure that is high.[6] This has caused renewed interest in suggestions that Earth’s water may be partly of asteroidal origin.
Deuterium has also been observed to be concentrated over the mean solar abundance in other terrestrial planets, in particular Mars and Venus.[16]
Production[edit]
Deuterium is produced for industrial, scientific and military purposes, by starting with ordinary water—a small fraction of which is naturally-occurring heavy water—and then separating out the heavy water by the Girdler sulfide process, distillation, or other methods.
In theory, deuterium for heavy water could be created in a nuclear reactor, but separation from ordinary water is the cheapest bulk production process.
The world’s leading supplier of deuterium was Atomic Energy of Canada Limited until 1997, when the last heavy water plant was shut down. Canada uses heavy water as a neutron moderator for the operation of the CANDU reactor design.
Another major producer of heavy water is India. All but one of India’s atomic energy plants are pressurised heavy water plants, which use natural (i.e., not enriched) uranium. India has eight heavy water plants, of which seven are in operation. Six plants, of which five are in operation, are based on D–H exchange in ammonia gas. The other two plants extract deuterium from natural water in a process that uses hydrogen sulphide gas at high pressure.
While India is self-sufficient in heavy water for its own use, India now also exports reactor-grade heavy water.
Properties[edit]
Data for molecular deuterium[edit]
Formula: D2 or 2
1H
2
- Density: 0.180 kg/m3 at STP (0 °C, 101.325 kPa).
- Atomic weight: 2.0141017926 Da.
- Mean abundance in ocean water (from VSMOW) 155.76 ± 0.1 ppm (a ratio of 1 part per approximately 6420 parts), that is, about 0.015% of the atoms in a sample (by number, not weight)
Data at approximately 18 K for D2 (triple point):
- Density:
- Liquid: 162.4 kg/m3
- Gas: 0.452 kg/m3
- Viscosity: 12.6 μPa·s at 300 K (gas phase)
- Specific heat capacity at constant pressure cp:
- Solid: 2950 J/(kg·K)
- Gas: 5200 J/(kg·K)
Physical properties[edit]
Compared to hydrogen in its natural composition on Earth, pure deuterium (D2) has a higher melting point (18.72 K vs. 13.99 K), a higher boiling point (23.64 K vs. 20.27 K), a higher critical temperature (38.3 K vs. 32.94 K) and a higher critical pressure (1.6496 MPa vs. 1.2858 MPa).[17]
The physical properties of deuterium compounds can exhibit significant kinetic isotope effects and other physical and chemical property differences from the protium analogs. D2O, for example, is more viscous than H2O.[18] Chemically, there are differences in bond energy and length for compounds of heavy hydrogen isotopes compared to protium, which are larger than the isotopic differences in any other element. Bonds involving deuterium and tritium are somewhat stronger than the corresponding bonds in protium, and these differences are enough to cause significant changes in biological reactions. Pharmaceutical firms are interested in the fact that deuterium is harder to remove from carbon than protium.[19]
Deuterium can replace protium in water molecules to form heavy water (D2O), which is about 10.6% denser than normal water (so that ice made from it sinks in ordinary water). Heavy water is slightly toxic in eukaryotic animals, with 25% substitution of the body water causing cell division problems and sterility, and 50% substitution causing death by cytotoxic syndrome (bone marrow failure and gastrointestinal lining failure). Prokaryotic organisms, however, can survive and grow in pure heavy water, though they develop slowly.[20] Despite this toxicity, consumption of heavy water under normal circumstances does not pose a health threat to humans. It is estimated that a 70 kg (154 lb) person might drink 4.8 litres (1.3 US gal) of heavy water without serious consequences.[21] Small doses of heavy water (a few grams in humans, containing an amount of deuterium comparable to that normally present in the body) are routinely used as harmless metabolic tracers in humans and animals.
Quantum properties[edit]
The deuteron has spin +1 («triplet state») and is thus a boson. The NMR frequency of deuterium is significantly different from common light hydrogen. Infrared spectroscopy also easily differentiates many deuterated compounds, due to the large difference in IR absorption frequency seen in the vibration of a chemical bond containing deuterium, versus light hydrogen. The two stable isotopes of hydrogen can also be distinguished by using mass spectrometry.
The triplet deuteron nucleon is barely bound at EB = 2.23 MeV, and none of the higher energy states are bound. The singlet deuteron is a virtual state, with a negative binding energy of ~60 keV. There is no such stable particle, but this virtual particle transiently exists during neutron-proton inelastic scattering, accounting for the unusually large neutron scattering cross-section of the proton.[22]
Nuclear properties (the deuteron)[edit]
Deuteron mass and radius[edit]
The nucleus of deuterium is called a deuteron. It has a mass of 2.013553212745(40) Da (just over 1.875 GeV).[23][24]
The charge radius of the deuteron is 2.12799(74) fm.[25]
Like the proton radius, measurements using muonic deuterium produce a smaller result: 2.12562(78) fm.[26]
Spin and energy[edit]
Deuterium is one of only five stable nuclides with an odd number of protons and an odd number of neutrons. (2
H
, 6
Li
, 10
B
, 14
N
, 180m
Ta
; also, the long-lived radioactive nuclides 40
K
, 50
V
, 138
La
, 176
Lu
occur naturally.) Most odd-odd nuclei are unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects. Deuterium, however, benefits from having its proton and neutron coupled to a spin-1 state, which gives a stronger nuclear attraction; the corresponding spin-1 state does not exist in the two-neutron or two-proton system, due to the Pauli exclusion principle which would require one or the other identical particle with the same spin to have some other different quantum number, such as orbital angular momentum. But orbital angular momentum of either particle gives a lower binding energy for the system, primarily due to increasing distance of the particles in the steep gradient of the nuclear force. In both cases, this causes the diproton and dineutron nucleus to be unstable.
The proton and neutron making up deuterium can be dissociated through neutral current interactions with neutrinos. The cross section for this interaction is comparatively large, and deuterium was successfully used as a neutrino target in the Sudbury Neutrino Observatory experiment.
Diatomic deuterium (D2) has ortho and para nuclear spin isomers like diatomic hydrogen, but with differences in the number and population of spin states and rotational levels, which occur because the deuteron is a boson with nuclear spin equal to one.[27]
Isospin singlet state of the deuteron[edit]
Due to the similarity in mass and nuclear properties between the proton and neutron, they are sometimes considered as two symmetric types of the same object, a nucleon. While only the proton has an electric charge, this is often negligible due to the weakness of the electromagnetic interaction relative to the strong nuclear interaction. The symmetry relating the proton and neutron is known as isospin and denoted I (or sometimes T).
Isospin is an SU(2) symmetry, like ordinary spin, so is completely analogous to it. The proton and neutron, each of which have isospin-1⁄2, form an isospin doublet (analogous to a spin doublet), with a «down» state (↓) being a neutron and an «up» state (↑) being a proton.[citation needed] A pair of nucleons can either be in an antisymmetric state of isospin called singlet, or in a symmetric state called triplet. In terms of the «down» state and «up» state, the singlet is
, which can also be written :
This is a nucleus with one proton and one neutron, i.e. a deuterium nucleus. The triplet is
and thus consists of three types of nuclei, which are supposed to be symmetric: a deuterium nucleus (actually a highly excited state of it), a nucleus with two protons, and a nucleus with two neutrons. These states are not stable.
Approximated wavefunction of the deuteron[edit]
The deuteron wavefunction must be antisymmetric if the isospin representation is used (since a proton and a neutron are not identical particles, the wavefunction
need not be antisymmetric in general). Apart from their isospin, the two nucleons also have spin and spatial distributions of their wavefunction. The latter is symmetric if the deuteron is symmetric under parity (i.e. have an «even» or «positive» parity), and antisymmetric if the deuteron is antisymmetric under parity (i.e. have an «odd» or «negative» parity). The parity is fully determined by the total orbital angular momentum of the two nucleons: if it is even then the parity is even (positive), and if it is odd then the parity is odd (negative).
The deuteron, being an isospin singlet, is antisymmetric under nucleons exchange due to isospin, and therefore must be symmetric under the double exchange of their spin and location. Therefore, it can be in either of the following two different states:
- Symmetric spin and symmetric under parity. In this case, the exchange of the two nucleons will multiply the deuterium wavefunction by (−1) from isospin exchange, (+1) from spin exchange and (+1) from parity (location exchange), for a total of (−1) as needed for antisymmetry.
- Antisymmetric spin and antisymmetric under parity. In this case, the exchange of the two nucleons will multiply the deuterium wavefunction by (−1) from isospin exchange, (−1) from spin exchange and (−1) from parity (location exchange), again for a total of (−1) as needed for antisymmetry.
In the first case the deuteron is a spin triplet, so that its total spin s is 1. It also has an even parity and therefore even orbital angular momentum l ; The lower its orbital angular momentum, the lower its energy. Therefore, the lowest possible energy state has s = 1, l = 0.
In the second case the deuteron is a spin singlet, so that its total spin s is 0. It also has an odd parity and therefore odd orbital angular momentum l. Therefore, the lowest possible energy state has s = 0, l = 1.
Since s = 1 gives a stronger nuclear attraction, the deuterium ground state is in the s = 1, l = 0 state.
The same considerations lead to the possible states of an isospin triplet having s = 0, l = even or s = 1, l = odd. Thus the state of lowest energy has s = 1, l = 1, higher than that of the isospin singlet.
The analysis just given is in fact only approximate, both because isospin is not an exact symmetry, and more importantly because the strong nuclear interaction between the two nucleons is related to angular momentum in spin–orbit interaction that mixes different s and l states. That is, s and l are not constant in time (they do not commute with the Hamiltonian), and over time a state such as s = 1, l = 0 may become a state of s = 1, l = 2. Parity is still constant in time so these do not mix with odd l states (such as s = 0, l = 1). Therefore, the quantum state of the deuterium is a superposition (a linear combination) of the s = 1, l = 0 state and the s = 1, l = 2 state, even though the first component is much bigger. Since the total angular momentum j is also a good quantum number (it is a constant in time), both components must have the same j, and therefore j = 1. This is the total spin of the deuterium nucleus.
To summarize, the deuterium nucleus is antisymmetric in terms of isospin, and has spin 1 and even (+1) parity. The relative angular momentum of its nucleons l is not well defined, and the deuteron is a superposition of mostly l = 0 with some l = 2.
Magnetic and electric multipoles[edit]
In order to find theoretically the deuterium magnetic dipole moment μ, one uses the formula for a nuclear magnetic moment
with
g(l) and g(s) are g-factors of the nucleons.
Since the proton and neutron have different values for g(l) and g(s), one must separate their contributions. Each gets half of the deuterium orbital angular momentum 

where subscripts p and n stand for the proton and neutron, and g(l)n = 0.
By using the same identities as here and using the value g(l)p = 1, we arrive at the following result, in units of the nuclear magneton μN
For the s = 1, l = 0 state (j = 1), we obtain
For the s = 1, l = 2 state (j = 1), we obtain
The measured value of the deuterium magnetic dipole moment, is 0.857 μN, which is 97.5% of the 0.879 μN value obtained by simply adding moments of the proton and neutron. This suggests that the state of the deuterium is indeed to a good approximation s = 1, l = 0 state, which occurs with both nucleons spinning in the same direction, but their magnetic moments subtracting because of the neutron’s negative moment.
But the slightly lower experimental number than that which results from simple addition of proton and (negative) neutron moments shows that deuterium is actually a linear combination of mostly s = 1, l = 0 state with a slight admixture of s = 1, l = 2 state.
The electric dipole is zero as usual.
The measured electric quadrupole of the deuterium is 0.2859 e·fm2. While the order of magnitude is reasonable, since the deuterium radius is of order of 1 femtometer (see below) and its electric charge is e, the above model does not suffice for its computation. More specifically, the electric quadrupole does not get a contribution from the l =0 state (which is the dominant one) and does get a contribution from a term mixing the l =0 and the l =2 states, because the electric quadrupole operator does not commute with angular momentum.
The latter contribution is dominant in the absence of a pure l = 0 contribution, but cannot be calculated without knowing the exact spatial form of the nucleons wavefunction inside the deuterium.
Higher magnetic and electric multipole moments cannot be calculated by the above model, for similar reasons.
Applications[edit]
Deuterium has a number of commercial and scientific uses. These include:
Nuclear reactors[edit]
Ionized deuterium in a fusor reactor giving off its characteristic pinkish-red glow
Deuterium is used in heavy water moderated fission reactors, usually as liquid D2O, to slow neutrons without the high neutron absorption of ordinary hydrogen.[28] This is a common commercial use for larger amounts of deuterium.
In research reactors, liquid D2 is used in cold sources to moderate neutrons to very low energies and wavelengths appropriate for scattering experiments.
Experimentally, deuterium is the most common nuclide used in nuclear fusion reactor designs, especially in combination with tritium, because of the large reaction rate (or nuclear cross section) and high energy yield of the D–T reaction. There is an even higher-yield D–3
He
fusion reaction, though the breakeven point of D–3
He
is higher than that of most other fusion reactions; together with the scarcity of 3
He
, this makes it implausible as a practical power source until at least D–T and D–D fusion reactions have been performed on a commercial scale. Commercial nuclear fusion is not yet an accomplished technology.
NMR spectroscopy[edit]

Deuterium is most commonly used in hydrogen nuclear magnetic resonance spectroscopy (proton NMR) in the following way. NMR ordinarily requires compounds of interest to be analyzed as dissolved in solution. Because of deuterium’s nuclear spin properties which differ from the light hydrogen usually present in organic molecules, NMR spectra of hydrogen/protium are highly differentiable from that of deuterium, and in practice deuterium is not «seen» by an NMR instrument tuned for light-hydrogen. Deuterated solvents (including heavy water, but also compounds like deuterated chloroform, CDCl3) are therefore routinely used in NMR spectroscopy, in order to allow only the light-hydrogen spectra of the compound of interest to be measured, without solvent-signal interference.
Nuclear magnetic resonance spectroscopy can also be used to obtain information about the deuteron’s environment in isotopically labelled samples (Deuterium NMR). For example, the configuration of hydrocarbon chains in lipid bilayers can be quantified using solid state deuterium NMR with deuterium-labelled lipid molecules.[29]
Deuterium NMR spectra are especially informative in the solid state because of its relatively small quadrupole moment in comparison with those of bigger quadrupolar nuclei such as chlorine-35, for example.
Tracing[edit]
In chemistry, biochemistry and environmental sciences, deuterium is used as a non-radioactive, stable isotopic tracer, for example, in the doubly labeled water test. In chemical reactions and metabolic pathways, deuterium behaves somewhat similarly to ordinary hydrogen (with a few chemical differences, as noted). It can be distinguished from ordinary hydrogen most easily by its mass, using mass spectrometry or infrared spectrometry. Deuterium can be detected by femtosecond infrared spectroscopy, since the mass difference drastically affects the frequency of molecular vibrations; deuterium-carbon bond vibrations are found in spectral regions free of other signals.
Measurements of small variations in the natural abundances of deuterium, along with those of the stable heavy oxygen isotopes 17O and 18O, are of importance in hydrology, to trace the geographic origin of Earth’s waters. The heavy isotopes of hydrogen and oxygen in rainwater (so-called meteoric water) are enriched as a function of the environmental temperature of the region in which the precipitation falls (and thus enrichment is related to mean latitude). The relative enrichment of the heavy isotopes in rainwater (as referenced to mean ocean water), when plotted against temperature falls predictably along a line called the global meteoric water line (GMWL). This plot allows samples of precipitation-originated water to be identified along with general information about the climate in which it originated. Evaporative and other processes in bodies of water, and also ground water processes, also differentially alter the ratios of heavy hydrogen and oxygen isotopes in fresh and salt waters, in characteristic and often regionally distinctive ways.[30] The ratio of concentration of 2H to 1H is usually indicated with a delta as δ2H and the geographic patterns of these values are plotted in maps termed as isoscapes. Stable isotopes are incorporated into plants and animals and an analysis of the ratios in a migrant bird or insect can help suggest a rough guide to their origins.[31][32]
Contrast properties[edit]
Neutron scattering techniques particularly profit from availability of deuterated samples: The H and D cross sections are very distinct and different in sign, which allows contrast variation in such experiments. Further, a nuisance problem of ordinary hydrogen is its large incoherent neutron cross section, which is nil for D. The substitution of deuterium atoms for hydrogen atoms thus reduces scattering noise.
Hydrogen is an important and major component in all materials of organic chemistry and life science, but it barely interacts with X-rays. As hydrogen (and deuterium) interact strongly with neutrons, neutron scattering techniques, together with a modern deuteration facility,[33] fills a niche in many studies of macromolecules in biology and many other areas.
Nuclear weapons[edit]
This is discussed below. It is notable that although most stars, including the Sun, generate energy over most of their lives by fusing hydrogen into heavier elements, such fusion of light hydrogen (protium) has never been successful in the conditions attainable on Earth. Thus, all artificial fusion, including the hydrogen fusion that occurs in so-called hydrogen bombs, requires heavy hydrogen (either tritium or deuterium, or both) in order for the process to work.
Drugs[edit]
A deuterated drug is a small molecule medicinal product in which one or more of the hydrogen atoms contained in the drug molecule have been replaced by deuterium. Because of the kinetic isotope effect, deuterium-containing drugs may have significantly lower rates of metabolism, and hence a longer half-life.[34][35][36] In 2017, deutetrabenazine became the first deuterated drug to receive FDA approval.[37]
Reinforced essential nutrients[edit]
Deuterium can be used to reinforce specific oxidation-vulnerable C-H bonds within essential or conditionally essential nutrients,[38] such as certain amino acids, or polyunsaturated fatty acids (PUFA), making them more resistant to oxidative damage. Deuterated polyunsaturated fatty acids, such as linoleic acid, slow down the chain reaction of lipid peroxidation that damage living cells.[39][40] Deuterated ethyl ester of linoleic acid (RT001), developed by Retrotope, is in a compassionate use trial in infantile neuroaxonal dystrophy and has successfully completed a Phase I/II trial in Friedreich’s ataxia.[41][37]
Thermostabilization[edit]
Live vaccines, such as the oral poliovirus vaccine, can be stabilized by deuterium, either alone or in combination with other stabilizers such as MgCl2.[42]
Slowing circadian oscillations[edit]
Deuterium has been shown to lengthen the period of oscillation of the circadian clock when dosed in rats, hamsters, and Gonyaulax dinoflagellates.[43][44][45][46] In rats, chronic intake of 25% D2O disrupts circadian rhythmicity by lengthening the circadian period of suprachiasmatic nucleus-dependent rhythms in the brain’s hypothalamus.[45] Experiments in hamsters also support the theory that deuterium acts directly on the suprachiasmatic nucleus to lengthen the free-running circadian period.[47]
History[edit]
Suspicion of lighter element isotopes[edit]
The existence of nonradioactive isotopes of lighter elements had been suspected in studies of neon as early as 1913, and proven by mass spectrometry of light elements in 1920. At that time the neutron had not yet been discovered, and the prevailing theory was that isotopes of an element differ by the existence of additional protons in the nucleus accompanied by an equal number of nuclear electrons. In this theory, the deuterium nucleus with mass two and charge one would contain two protons and one nuclear electron. However, it was expected that the element hydrogen with a measured average atomic mass very close to 1 Da, the known mass of the proton, always has a nucleus composed of a single proton (a known particle), and could not contain a second proton. Thus, hydrogen was thought to have no heavy isotopes.
Deuterium detected[edit]

It was first detected spectroscopically in late 1931 by Harold Urey, a chemist at Columbia University. Urey’s collaborator, Ferdinand Brickwedde, distilled five liters of cryogenically produced liquid hydrogen to 1 mL of liquid, using the low-temperature physics laboratory that had recently been established at the National Bureau of Standards in Washington, D.C. (now the National Institute of Standards and Technology). The technique had previously been used to isolate heavy isotopes of neon. The cryogenic boiloff technique concentrated the fraction of the mass-2 isotope of hydrogen to a degree that made its spectroscopic identification unambiguous.[48][49]
Naming of the isotope and Nobel Prize[edit]
Urey created the names protium, deuterium, and tritium in an article published in 1934. The name is based in part on advice from G. N. Lewis who had proposed the name «deutium». The name is derived from the Greek deuteros (‘second’), and the nucleus to be called «deuteron» or «deuton». Isotopes and new elements were traditionally given the name that their discoverer decided. Some British scientists, such as Ernest Rutherford, wanted the isotope to be called «diplogen», from the Greek diploos (‘double’), and the nucleus to be called «diplon».[3][50]
The amount inferred for normal abundance of this heavy isotope of hydrogen was so small (only about 1 atom in 6400 hydrogen atoms in ocean water (156 deuteriums per million hydrogens)) that it had not noticeably affected previous measurements of (average) hydrogen atomic mass. This explained why it hadn’t been experimentally suspected before. Urey was able to concentrate water to show partial enrichment of deuterium. Lewis had prepared the first samples of pure heavy water in 1933. The discovery of deuterium, coming before the discovery of the neutron in 1932, was an experimental shock to theory, but when the neutron was reported, making deuterium’s existence more explainable, deuterium won Urey the Nobel Prize in Chemistry in 1934. Lewis was embittered by being passed over for this recognition given to his former student.[3]
«Heavy water» experiments in World War II[edit]
Shortly before the war, Hans von Halban and Lew Kowarski moved their research on neutron moderation from France to Britain, smuggling the entire global supply of heavy water (which had been made in Norway) across in twenty-six steel drums.[51][52]
During World War II, Nazi Germany was known to be conducting experiments using heavy water as moderator for a nuclear reactor design. Such experiments were a source of concern because they might allow them to produce plutonium for an atomic bomb. Ultimately it led to the Allied operation called the «Norwegian heavy water sabotage», the purpose of which was to destroy the Vemork deuterium production/enrichment facility in Norway. At the time this was considered important to the potential progress of the war.
After World War II ended, the Allies discovered that Germany was not putting as much serious effort into the program as had been previously thought. The Germans had completed only a small, partly built experimental reactor (which had been hidden away) and had been unable to sustain a chain reaction. By the end of the war, the Germans did not even have a fifth of the amount of heavy water needed to run the reactor,[clarification needed] partially due to the Norwegian heavy water sabotage operation. However, even if the Germans had succeeded in getting a reactor operational (as the U.S. did with Chicago Pile-1 in late 1942), they would still have been at least several years away from the development of an atomic bomb. The engineering process, even with maximal effort and funding, required about two and a half years (from first critical reactor to bomb) in both the U.S. and U.S.S.R., for example.
In thermonuclear weapons[edit]

The «Sausage» device casing of the Ivy Mike H bomb, attached to instrumentation and cryogenic equipment. The 20-ft-tall bomb held a cryogenic Dewar flask with room for 160 kg of liquid deuterium.
The 62-ton Ivy Mike device built by the United States and exploded on 1 November 1952, was the first fully successful «hydrogen bomb» (thermonuclear bomb). In this context, it was the first bomb in which most of the energy released came from nuclear reaction stages that followed the primary nuclear fission stage of the atomic bomb. The Ivy Mike bomb was a factory-like building, rather than a deliverable weapon. At its center, a very large cylindrical, insulated vacuum flask or cryostat, held cryogenic liquid deuterium in a volume of about 1000 liters (160 kilograms in mass, if this volume had been completely filled). Then, a conventional atomic bomb (the «primary») at one end of the bomb was used to create the conditions of extreme temperature and pressure that were needed to set off the thermonuclear reaction.
Within a few years, so-called «dry» hydrogen bombs were developed that did not need cryogenic hydrogen. Released information suggests that all thermonuclear weapons built since then contain chemical compounds of deuterium and lithium in their secondary stages. The material that contains the deuterium is mostly lithium deuteride, with the lithium consisting of the isotope lithium-6. When the lithium-6 is bombarded with fast neutrons from the atomic bomb, tritium (hydrogen-3) is produced, and then the deuterium and the tritium quickly engage in thermonuclear fusion, releasing abundant energy, helium-4, and even more free neutrons. «Pure» fusion weapons such as the Tsar Bomba are believed to be obsolete. In most modern («boosted») thermonuclear weapons, fusion directly provides only a small fraction of the total energy. Fission of a natural uranium U-238 tamper by fast neutrons produced from D-T fusion accounts for a much larger (i.e. boosted) energy release than the fusion reaction itself.
Modern research[edit]
In August 2018, scientists announced the transformation of gaseous deuterium into a liquid metallic form. This may help researchers better understand giant gas planets, such as Jupiter, Saturn and related exoplanets, since such planets are thought to contain a large quantity of liquid metallic hydrogen, which may be responsible for their observed powerful magnetic fields.[53][54]
Antideuterium[edit]
An antideuteron is the antimatter counterpart of the nucleus of deuterium, consisting of an antiproton and an antineutron. The antideuteron was first produced in 1965 at the Proton Synchrotron at CERN[55] and the Alternating Gradient Synchrotron at Brookhaven National Laboratory.[56] A complete atom, with a positron orbiting the nucleus, would be called antideuterium, but as of 2019 antideuterium has not yet been created. The proposed symbol for antideuterium is
D
, that is, D with an overbar.[57]
See also[edit]
- Isotopes of hydrogen
- Nuclear fusion
- Tokamak
- Tritium
- Heavy water
References[edit]
- ^ Hagemann R, Nief G, Roth E (1970). «Absolute isotopic scale for deuterium analysis of natural waters. Absolute D/H ratio for SMOW 1». Tellus. 22 (6): 712–715. doi:10.1111/j.2153-3490.1970.tb00540.x.
- ^ Wang, M.; Audi, G.; Kondev, F. G.; Huang, W. J.; Naimi, S.; Xu, X. (2017). «The AME2016 atomic mass evaluation (II). Tables, graphs, and references» (PDF). Chinese Physics C. 41 (3): 030003-1–030003-442. doi:10.1088/1674-1137/41/3/030003.
- ^ a b c O’Leary D (February 2012). «The deeds to deuterium». Nature Chemistry. 4 (3): 236. Bibcode:2012NatCh…4..236O. doi:10.1038/nchem.1273. PMID 22354440.
- ^ a b Hartogh P, Lis DC, Bockelée-Morvan D, de Val-Borro M, Biver N, Küppers M, et al. (October 2011). «Ocean-like water in the Jupiter-family comet 103P/Hartley 2». Nature. 478 (7368): 218–220. Bibcode:2011Natur.478..218H. doi:10.1038/nature10519. PMID 21976024. S2CID 3139621.
- ^ a b c Hersant F, Gautier D, Hure J (2001). «A two-dimensional model for the primordial nebula constrained by D/H measurements in the Solar system: Implications for the formation of giant planets». The Astrophysical Journal. 554 (1): 391–407. Bibcode:2001ApJ…554..391H. doi:10.1086/321355. — see fig. 7. for a review of D/H ratios in various astronomical objects
- ^ a b Altwegg K, Balsiger H, Bar-Nun A, Berthelier JJ, Bieler A, Bochsler P, et al. (January 2015). «Cometary science. 67P/Churyumov–Gerasimenko, a Jupiter family comet with a high D/H ratio» (PDF). Science. 347 (6220): 1261952. Bibcode:2015Sci…347A.387A. doi:10.1126/science.1261952. PMID 25501976. S2CID 206563296.
- ^ «Provisional Recommendations». Nomenclature of Inorganic Chemistry. Chemical Nomenclature and Structure Representation Division. IUPAC. § IR-3.3.2. Archived from the original on 27 October 2006. Retrieved 3 October 2007.
- ^ Hébrard G, Péquignot D, Vidal-Madjar A, Walsh JR, Ferlet R (7 February 2000). «Detection of deuterium Balmer lines in the Orion Nebula». Astronomy and Astrophysics. 354: L79. arXiv:astro-ph/0002141. Bibcode:2000A&A…354L..79H.
- ^ «Water absorption spectrum». London South Bank University (lsbu.ac.uk). London, UK. Archived from the original on 27 July 2017.
- ^ Weiss A. «Equilibrium and change: The physics behind Big Bang nucleosynthesis». Einstein Online. Archived from the original on 8 February 2007. Retrieved 24 February 2007.
- ^ IUPAC Commission on Nomenclature of Inorganic Chemistry (2001). «Names for muonium and hydrogen atoms and their ions» (PDF). Pure and Applied Chemistry. 73 (2): 377–380. doi:10.1351/pac200173020377. S2CID 97138983. Archived (PDF) from the original on 25 April 2003.
- ^ «Cosmic Detectives». The European Space Agency (ESA). 2 April 2013. Retrieved 15 April 2013.
- ^ «FUSE Satellite solves the case of the missing deuterium» (Press release). NASA.
- ^ «Graph of deuterium with distance in our galactic neighborhood». FUSE Satellite project. Baltimore, MD: Johns Hopkins University. Archived from the original on 5 December 2013.
- See also
Linsky JL, Draine BT, Moos HW, Jenkins EB, Wood BE, Oliveira C, et al. (2006). «What is the Total Deuterium Abundance in the Local Galactic Disk?». The Astrophysical Journal. 647 (2): 1106–1124. arXiv:astro-ph/0608308. Bibcode:2006ApJ…647.1106L. doi:10.1086/505556. S2CID 14461382.
- ^ Lellouch E, Bézard B, Fouchet T, Feuchtgruber H, Encrenaz T, de Graauw T (2001). «The deuterium abundance in Jupiter and Saturn from ISO-SWS observations» (PDF). Astronomy & Astrophysics. 670 (2): 610–622. Bibcode:2001A&A…370..610L. doi:10.1051/0004-6361:20010259.
- ^ Hunten DM (1993). «Atmospheric evolution of the terrestrial planets». Science. 259 (5097): 915–920. Bibcode:1993Sci…259..915H. doi:10.1126/science.259.5097.915. ISSN 0036-8075. JSTOR 2880608. S2CID 178360068.
- ^ «Deuterium, 2H». PubChem. compounds. U.S. National Institutes of Health.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Halford B (4 July 2016). «The deuterium switcheroo». Chemical & Engineering News. American Chemical Society. pp. 32–36.
- ^ Kushner DJ, Baker A, Dunstall TG (February 1999). «Pharmacological uses and perspectives of heavy water and deuterated compounds». Canadian Journal of Physiology and Pharmacology. 77 (2): 79–88. doi:10.1139/cjpp-77-2-79. PMID 10535697.
- ^ Vertes, Attila, ed. (2003). «Physiological effect of heavy water». Elements and isotopes: formation, transformation, distribution. Dordrecht: Kluwer. pp. 111–112. ISBN 978-1-4020-1314-0.
- ^ «Neutron-proton scattering» (PDF). mightylib.mit.edu (course notes). Massachusetts Institute of Technology. Fall 2004. 22.101. Archived from the original (PDF) on 21 July 2011. Retrieved 23 November 2011.
- ^ «Deuteron mass in u». Physics.nist.gov. U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ «Deuteron mass energy equivalent in MeV». Physics.nist.gov. U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ «Deuteron RMS charge radius Physics.nist.gov». U.S. National Institute of Standards and Technology. Retrieved 18 September 2020.
- ^ Pohl R, Nez F, Fernandes LM, Amaro FD, Biraben F, Cardoso JM, et al. (The CREMA Collaboration) (August 2016). «Laser spectroscopy of muonic deuterium». Science. 353 (6300): 669–673. Bibcode:2016Sci…353..669P. doi:10.1126/science.aaf2468. hdl:10316/80061. PMID 27516595. S2CID 206647315.
- ^ Hollas JM (1996). Modern Spectroscopy (3rd ed.). John Wiley and Sons. p. 115. ISBN 0-471-96523-5.
- ^ See neutron cross section#Typical cross sections
- ^ Seelig J (October 1971). «On the flexibility of hydrocarbon chains in lipid bilayers». Journal of the American Chemical Society. 93 (20): 5017–5022. doi:10.1021/ja00749a006. PMID 4332660.
- ^ «Oxygen – Isotopes and Hydrology». SAHRA. Archived from the original on 2 January 2007. Retrieved 10 September 2007.
- ^ West JB (2009). Isoscapes: Understanding movement, pattern, and process on Earth through isotope mapping. Springer.
- ^ Hobson KA, Van Wilgenburg SL, Wassenaar LI, Larson K (2012). «Linking hydrogen (δ2H) isotopes in feathers and precipitation: Sources of variance and consequences for assignment to isoscapes». PLOS ONE. 7 (4): e35137. Bibcode:2012PLoSO…735137H. doi:10.1371/journal.pone.0035137. PMC 3324428. PMID 22509393.
- ^ «Deuteration». nmi3.eu. Integrated Infrastructure Initiative for Neutron Scattering and Muon Spectroscopy (NMI3). Archived from the original on 3 February 2019. Retrieved 23 January 2012.
- ^ Sanderson K (March 2009). «Big interest in heavy drugs». Nature. 458 (7236): 269. doi:10.1038/458269a. PMID 19295573. S2CID 4343676.
- ^ Katsnelson A (June 2013). «Heavy drugs draw heavy interest from pharma backers». Nature Medicine. 19 (6): 656. doi:10.1038/nm0613-656. PMID 23744136. S2CID 29789127.
- ^ Gant TG (May 2014). «Using deuterium in drug discovery: Leaving the label in the drug». Journal of Medicinal Chemistry. 57 (9): 3595–3611. doi:10.1021/jm4007998. PMID 24294889.
- ^ a b Schmidt C (June 2017). «First deuterated drug approved». Nature Biotechnology. 35 (6): 493–494. doi:10.1038/nbt0617-493. PMID 28591114. S2CID 205269152.
- ^ Demidov VV (September 2007). «Heavy isotopes to avert ageing?». Trends in Biotechnology. 25 (9): 371–375. doi:10.1016/j.tibtech.2007.07.007. PMID 17681625.
- ^ Halliwell, Barry; Gutteridge, John M.C. (2015). Free Radical Biology and Medicine (5th ed.). Oxford: Clarendon Press. ISBN 9780198717485.
- ^ Hill S, Lamberson CR, Xu L, To R, Tsui HS, Shmanai VV, et al. (August 2012). «Small amounts of isotope-reinforced polyunsaturated fatty acids suppress lipid autoxidation». Free Radical Biology & Medicine. 53 (4): 893–906. doi:10.1016/j.freeradbiomed.2012.06.004. PMC 3437768. PMID 22705367.
- ^ «A Randomized, Double-blind, Controlled Study to Assess the Safety, Tolerability, and Pharmacokinetics of RT001 in Patients with Friedreich’s Ataxia». 24 November 2020.
- ^ Wu R, Georgescu MM, Delpeyroux F, Guillot S, Balanant J, Simpson K, Crainic R (August 1995). «Thermostabilization of live virus vaccines by heavy water (D2O)». Vaccine. 13 (12): 1058–1063. doi:10.1016/0264-410X(95)00068-C. PMID 7491812.
- ^ Lesauter J, Silver R (September 1993). «Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts». Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. ISSN 0031-9384. PMID 8415956. S2CID 32466816.
- ^ McDaniel M, Sulzman FM, Hastings JW (November 1974). «Heavy water slows the Gonyaulax clock: a test of the hypothesis that D2O affects circadian oscillations by diminishing the apparent temperature». Proceedings of the National Academy of Sciences of the United States of America. 71 (11): 4389–4391. Bibcode:1974PNAS…71.4389M. doi:10.1073/pnas.71.11.4389. PMC 433889. PMID 4530989.
- ^ a b Petersen CC, Mistlberger RE (August 2017). «Interval timing is preserved despite circadian desynchrony in rats: Constant light and heavy water studies». Journal of Biological Rhythms. 32 (4): 295–308. doi:10.1177/0748730417716231. PMID 28651478. S2CID 4633617.
- ^ Richter CP (March 1977). «Heavy water as a tool for study of the forces that control length of period of the 24-hour clock of the hamster». Proceedings of the National Academy of Sciences of the United States of America. 74 (3): 1295–1299. Bibcode:1977PNAS…74.1295R. doi:10.1073/pnas.74.3.1295. PMC 430671. PMID 265574.
- ^ Lesauter J, Silver R (September 1993). «Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts». Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. PMID 8415956. S2CID 32466816.
- ^ Brickwedde FG (1982). «Harold Urey and the discovery of deuterium». Physics Today. Vol. 35, no. 9. p. 34. Bibcode:1982PhT….35i..34B. doi:10.1063/1.2915259.
- ^ Urey H, Brickwedde F, Murphy G (1932). «A hydrogen isotope of mass 2». Physical Review. 39 (1): 164–165. Bibcode:1932PhRv…39..164U. doi:10.1103/PhysRev.39.164.
- ^ «Deuterium v. Diplogen». Science. Time. 19 February 1934. Archived from the original on 15 September 2009.
- ^ Sherriff L (1 June 2007). «Royal Society unearths top secret nuclear research». The Register. Situation Publishing Ltd. Retrieved 3 June 2007.
- ^ The battle for heavy water: Three physicists’ heroic exploits. CERN Bulletin (Report). European Organization for Nuclear Research. 25 March 2002. Retrieved 2 November 2015.
- ^ Chang K (16 August 2018). «Settling arguments about hydrogen with 168 giant lasers». The New York Times. Archived from the original on 1 January 2022. Retrieved 18 August 2018.
- ^ «Under pressure, hydrogen offers a reflection of giant planet interiors» (Press release). Carnegie Institution for Science. 15 August 2018. Retrieved 19 August 2018.
- ^ Massam T, Muller T, Righini B, Schneegans M, Zichichi A (1965). «Experimental observation of antideuteron production». Il Nuovo Cimento. 39 (1): 10–14. Bibcode:1965NCimS..39…10M. doi:10.1007/BF02814251. S2CID 122952224.
- ^ Dorfan DE, Eades J, Lederman LM, Lee W, Ting CC (June 1965). «Observation of antideuterons». Physical Review Letters. 14 (24): 1003–1006. Bibcode:1965PhRvL..14.1003D. doi:10.1103/PhysRevLett.14.1003.
- ^ Chardonnet P, Orloff J, Salati P (1997). «The production of anti-matter in our galaxy». Physics Letters B. 409 (1–4): 313–320. arXiv:astro-ph/9705110. Bibcode:1997PhLB..409..313C. doi:10.1016/S0370-2693(97)00870-8. S2CID 118919611.
External links[edit]
![]()
Look up deuterium in Wiktionary, the free dictionary.
- «Nuclear Data Center». KAERI.
- «Annotated bibliography for deuterium». ALSOS: The Digital Library for Nuclear Issues. Lexington, VA: Washington and Lee University. Archived from the original on 5 May 2010. Retrieved 26 November 2019.
- Mullins, Justin (27 April 2005). «Desktop nuclear fusion demonstrated». New Scientist.
- Lloyd, Robin (21 August 2006). «Missing gas found in Milky Way». Space.com.
Дейтерий
- Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 году американским физико-химиком Гарольдом Юри. Природное содержание — 0,0115 ± 0,0070 %.
Источник: Википедия
Связанные понятия
Про́тий — название самого лёгкого изотопа водорода, обозначается символом 1H. Ядро протия состоит из одного протона, отсюда и название изотопа. Оно было предложено 15 июня 1933 года Юри, Мерфи и Брикведде в письме редактору научного журнала «The Journal of Chemical Physics», где они отметили, что произвели название «протий» (англ. protium) от греческого слова «protos» («первый»).
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством…
Ге́лий (He, лат. helium) — второй химический элемент периодической системы. Относится к 18-й группе, первому периоду системы и возглавляет группу инертных газов. Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
А́льфа-распа́д — вид радиоактивного распада ядра, в результате которого происходит испускание дважды магического ядра гелия 4He — альфа-частицы. При этом массовое число ядра уменьшается на 4, а атомный номер — на 2.
Тепловые нейтроны или медленные нейтроны — свободные нейтроны, кинетическая энергия которых близка к средней энергии теплового движения молекул газа при комнатной температуре (примерно 0,025 эВ).
Упоминания в литературе
Однако на сегодняшний день существует интересная точка зрения, высказываемая В.М. Мухачевым, которая немного открывает тайну «живой» и «мертвой» воды. Дело в том, что атомы водорода и кислорода, входящие в состав воды, могут иметь разные массовые числа, отличаться по своим физико-химическим свойствам, но иметь одинаковый электрический заряд атомных ядер. Такие разновидности атомов одного и того же химического элемента называются изотопами. Изотопный состав определяет некоторые свойства воды: наличие изотопа водорода, именуемого дейтерием, делает ее «мертвой», а наличие протия – «живой».
Впервые тяжелую природную воду обнаружил в 1932 году химик Г. Юри, впоследствии награжденный за это Нобелевской премией. В следующем году Г. Льюис выделил тяжеловодородную воду в чистом виде. Необходимо отметить, что вероятность обнаружения атома дейтерия в естественной воде составляет 1: 6400. Ученые выяснили, что он обычно содержится в молекулах полутяжелой воды. Причем одна такая молекула приходится на 3200 молекул обычной воды. Так как в природе соединение двух атомов дейтерия в одной молекуле маловероятно, образование молекул тяжелой воды является проблематичным. Ученые получают тяжеловодородную воду искусственным способом, используя повышение концентрации дейтерия в воде.
Конечно, технологии «детритизации» в мире есть. Только очень недешевые. Экономически, увы, нецелесообразные. Скажем, вот отделение трития от водорода методом низкотемпературной ректификации водорода (Франция, Гренобль). Или, например, ректификация воды с рекомпрессией пара (опытная установка фирмы «Зульцер»). Или, к примеру, химический изотопный обмен в системе вода – сероводород, вода – водород, вода – аммиак (экспериментальные установки). Есть, наконец, адсорбционная очистка с использованием цеолитов и некоторых металлов. Эффективность и экономическая целесообразность выделения и концентрирования трития из тритийсодержащих отходов с помощью разделительных установок определяется, в конечном счете, энергетическими затратами на процесс разделения изотопов водорода: протия, дейтерия и трития. А они получаются огромными. Петрик же смог сделать новую технологию, стоящую вне конкуренции по своей дешевизне.
Главным образом, за счет продолжающегося медленного сжатия. Потенциальная энергия слоев, лежащих выше, при их опускании просто-напросто переходит в тепловую энергию частиц. Но температура в ядре звезды типа Т Тельца еще недостаточна для «возгорания» водорода. Для протон-протонной реакции требуется температура хотя бы 4–5 млн К, а такой температуры в ядре еще нет. Правда, при меньших (порядка 1 млн К) температурах идут реакции на дейтерии и литии, но они не способны остановить сжатие. Дейтерия и лития просто мало. Типичный состав межзвездной среды, идущей на образование звезд, в нашу эпоху примерно таков: на 1000 атомов приходятся 900 атомов водорода, 90 атомов гелия и лишь 10 атомов других элементов. Где уж малочисленным атомам дейтерия и лития обеспечить энерговыделение, способное остановить сжатие протозвезды! Заметим в скобках, что лития в межзвездной среде в нашу эпоху гораздо меньше, чем было в догалактическую (но уже «вещественную») эру существования Вселенной. Мы помним, что вещество, из которого возникло Солнце (и, конечно, все звезды, формирующееся в наше время), имеет «вторичное происхождение», то есть в прошлом побывало (и не раз) в недрах звезд более ранних поколений. По этой причине лития в межзвездной среде в нашу эпоху очень мало. Дейтерия несколько больше, и именно он горит в ядре протозвезды, все равно, впрочем, не конкурируя по энерговыделению с процессом сжатия!
На следующем этапе дейтерий взаимодействует с еще одним протоном. Образуется изотоп гелия 3He и рождается гамма-квант. У гелия-3 есть несколько возможностей для дальнейших реакций. Реже всего – в ничтожно малой доле случаев – в реакцию вступает протон, образуя на выходе 4He, позитрон и электронное нейтрино (эти нейтрино крайне важны, несмотря на свою редкость, поскольку они имеют самую высокую энергию).
Примерно в это время на каждый протон «замораживается» по одному электрону. Космос остывает, температура падает уже ниже ста миллионов градусов, и протоны связываются с другими протонами, а также с нейтронами: так формируются ядра атомов и зарождается Вселенная, в которой 90 % ядер – водород и 10 % – гелий плюс мизерное количество дейтерия («тяжелого» водорода), трития (еще более тяжелого водорода) и лития.
Очень важно, что обычных (естественно, с нашей точки зрения) частиц оказалось чуть больше, нежели античастиц. Эта разница была микроскопической, порядка стотысячных долей процента, но все же не нулевой. В результате, когда Вселенная охладилась настолько, что излучение перестало рождать новые частицы, вся антиматерия исчезла в процессе аннигиляции. Через 30 микросекунд после Большого взрыва субэлементарные кварки и связывающие их глюоны сконденсировались в нуклоны-протоны и нейтроны, а где-то на десятой секунде наступила эра первичного нуклеосинтеза, то есть возникновения композитных ядер гелия, дейтерия и лития.
Польза талой воды заключается также в том, что в ней в отличие от водопроводной нет дейтерия – тяжелого элемента, который подавляет все живое и наносит серьезный вред организму. Дейтерий в больших концентрациях равнозначен самым сильным ядам. Он плохо усваивается, что требует дополнительного расхода энергии. Талая же вода сама по себе обладает большой внутренней энергией и обеспечивает человеку хорошую энергетическую подпитку.
Связанные понятия (продолжение)
Изотопная распространённость (или распространённость изотопов) — относительное количество атомов разных изотопов одного химического элемента; обычно выражается в % к сумме атомов всех долгоживущих (с периодом полураспада Т > 3⋅108 лет) изотопов данного элемента в среднем в природе (либо с отнесением к той или иной природной среде, планете, региону и т. п.). Точное измерение изотопной распространённости имеет большое значение для определения атомных масс элементов.
Я́дерная реа́кция — это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, который может сопровождаться изменением состава и строения ядра. Последствием взаимодействия может стать деление ядра, испускание элементарных частиц или фотонов. Кинетическая энергия вновь образованных частиц может быть гораздо выше первоначальной, при этом говорят о выделении энергии ядерной реакцией.
Термоядерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые за счёт кинетической энергии их теплового движения.
Нуклеоси́нтез (от лат. nucleus «ядро» и др.-греч. σύνθεσις «соединение, составление») — природный процесс образования ядер химических элементов тяжелее водорода. Нуклеосинтез является причиной наблюдаемой распространённости химических элементов и их изотопов.
Дейтро́н (дейто́н) — ядро изотопа водорода — дейтерия — с массовым числом A=2. Обозначается 2H, D или d.
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1. Обладая 1 а. е. м., водород является самым легким элементом в периодической таблице. Его одноатомная форма (H) — самое распространённое химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы. Звезды, кроме компактных, в основном состоят из водородной плазмы. Самый распространенный изотоп водорода, называемый протием (название редко употребляется; обозначение…
Бе́та-распа́д (β-распад) — тип радиоактивного распада, обусловленный слабым взаимодействием и изменяющий заряд ядра на единицу без изменения массового числа. При этом распаде ядро излучает бета-частицу (электрон или позитрон), а также нейтральную частицу с полуцелым спином (электронное антинейтрино или электронное нейтрино)
Быстрые нейтроны — свободные нейтроны, кинетическая энергия которых больше некоторой величины, конкретное значение которой зависит от контекста, в котором используется термин.
Изомери́я а́томных я́дер — явление существования у ядер атомов метастабильных (изомерных) возбуждённых состояний с достаточно большим временем жизни.
Радиоакти́вный распа́д (от лат. radius «луч» и āctīvus «действенный», через фр. radioactif, букв. — «радиоактивность») — спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер (нуклидов) путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие нуклиды — радиоактивными (радионуклидами). Радиоактивными называют также вещества, содержащие радиоактивные…
Прото́н (от др.-греч. πρῶτος — первый, основной) — элементарная частица. Относится к барионам, имеет спин 1/2 и положительный электрический заряд +1 e. Стабилен.
Изотопы никеля — разновидности химического элемента никеля, имеющие разное количество нейтронов в ядре.
Протон-протонный цикл — совокупность термоядерных реакций, в ходе которых водород превращается в гелий в звёздах, находящихся на главной звездной последовательности; основная альтернатива CNO-циклу. Протон-протонный цикл доминирует в звёздах с массой порядка массы Солнца или меньше, на него приходится до 98% выделяемой энергии.
Трансура́новые элеме́нты (заурановые элементы, трансураны) — радиоактивные химические элементы, расположенные в периодической системе элементов Д. И. Менделеева за ураном, то есть с атомным номером выше 92.
Изотопы кислорода — разновидности атомов (и ядер) химического элемента кислорода, имеющие разное содержание нейтронов в ядре.
Арго́н — элемент 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон — инертный одноатомный газ без цвета, вкуса и запаха.
Нейтро́н (от лат. neuter — ни тот, ни другой) — тяжёлая элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Нейтроны и протоны являются двумя главными компонентами атомных ядер; общее название для протонов и нейтронов — нуклоны.
Нейтро́нный захва́т — вид ядерной реакции, в которой ядро атома соединяется с нейтроном и образует более тяжёлое ядро…
Замедле́ние нейтро́нов — процесс уменьшения кинетической энергии свободных нейтронов в результате их многократных столкновений с атомными ядрами вещества. Вещество, в котором происходит процесс замедления нейтронов, называется замедли́телем. Замедление нейтронов применяется, например, в ядерных реакторах на тепловых нейтронах.
Изотопы кобальта — разновидности химического элемента кобальта, имеющие разное количество нейтронов в ядре.
А́томная ма́сса — масса атома. Единица измерения в СИ — килограмм, по факту обычно применяется внесистемная единица атомная единица массы.
Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжёловодородной воды, известной также как оксид дейтерия. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха. Формула тяжёловодородной воды обычно записывается как D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная…
Иониза́ция — эндотермический процесс образования ионов из нейтральных атомов или молекул.
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения.
Деле́ние ядра́ — процесс расщепления атомного ядра на два (реже три) ядра с близкими массами, называемых осколками деления. В результате деления могут возникать и другие продукты реакции: лёгкие ядра (в основном альфа-частицы), нейтроны и гамма-кванты. Деление бывает спонтанным (самопроизвольным) и вынужденным (в результате взаимодействия с другими частицами, прежде всего, с нейтронами). Деление тяжёлых ядер — экзотермический процесс, в результате которого высвобождается большое количество энергии…
Изотопы висмута — разновидности химического элемента висмута, имеющие разное количество нейтронов в ядре.
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
Зарядовое число атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева.
Моноизотопный элемент, мононуклидный элемент, изотопно-чистый элемент, однородный элемент — химический элемент, характеристический изотопный состав которого включает только один изотоп. То есть такой элемент представлен в природе только одним изотопом.
Нейтронное излучение возникает при ядерных реакциях (в ядерных реакторах, промышленных и…
Изото́пы лития — разновидности атомов (и ядер) химического элемента лития, имеющие разное содержание нейтронов в ядре. На данный момент известны 9 изотопов лития и ещё 2 возбуждённых изомерных состояний некоторых его нуклидов, 10m1Li − 10m2Li.
Нео́н (Ne, лат. neon) — химический элемент 18-й группы, второго периода периодической системы с атомным номером 10. Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Как простое вещество представляет собой инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Цепна́я я́дерная реа́кция — последовательность единичных ядерных реакций, каждая из которых вызывается частицей, появившейся как продукт реакции на предыдущем шаге последовательности. Примером цепной ядерной реакции является цепная реакция деления ядер тяжёлых элементов, при которой основное число актов деления инициируется нейтронами, полученными при делении ядер в предыдущем поколении.
Амери́ций — химический элемент с атомным номером 95. Принадлежит к 3-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе III группы, или к группе IIIB), находится в седьмом периоде таблицы. Относится к семейству актиноидов. В природе отсутствует, массовое число наиболее стабильного из известных изотопов равно 243(его атомная масса равна 243,06138(2) а. е. м.). Обозначается символом Am (от лат. Americium). Четвёртый…
Барн (русское обозначение: б, бн; международное: b) — внесистемная единица измерения площади, используется в ядерной физике для измерения эффективного сечения ядерных реакций, а также квадрупольного момента. 1 барн равен 10−28 м² = 10−24 см² = 100 фм² (примерный размер атомного ядра). Определяются также кратные и дольные единицы; из них используются…
Изотопы железа — разновидности химического элемента железа, имеющие разное количество нейтронов в ядре.
Кю́рий (лат. Curium (Cm)) — 96-й элемент таблицы Менделеева, синтезированный трансурановый элемент.
Металли́ческий водоро́д — совокупность фазовых состояний водорода, находящегося при крайне высоком давлении и претерпевшего фазовый переход. Металлический водород представляет собой вырожденное состояние вещества и, по некоторым предположениям, может обладать некоторыми специфическими свойствами — высокотемпературной сверхпроводимостью и высокой удельной теплотой фазового перехода.
Гидрид лития — соединение щелочного металла лития и водорода. В расплавленном состоянии восстанавливает оксиды металлов и неметаллов. Под действием рентгеновского и ультрафиолетового излучения окрашивается в голубой цвет.
Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха.
Разделе́ние изото́пов — технологический процесс изменения изотопного состава вещества, состоящего из смеси различных изотопов одного химического элемента. Из одной смеси изотопов или химических соединений на выходе процесса получают две смеси: одна с повышенным содержанием требуемого изотопа (обогащенная смесь), другая с пониженным (обедненная смесь).
Изотопы технеция — разновидности атомов (и ядер) химического элемента технеция, имеющие разное содержание нейтронов в ядре.
В ядерной физике магические числа — натуральные числа, соответствующие количеству нуклонов в атомном ядре, при котором становится полностью заполненной какая-либо его оболочка.
Наведённая радиоактивность — это радиоактивность веществ, возникающая под действием облучения их ионизирующим излучением, особенно нейтронами.
Флеро́вий (лат. Flerovium, Fl), ранее был известен как унунква́дий (лат. Ununquadium, Uuq), использовалось также неофициальное название эка-свинец — 114-й химический элемент 14-й группы (по устаревшей классификации — главной подгруппы IV группы), 7-го периода периодической системы, атомный номер 114, из известных изотопов наиболее устойчив 289Fl с атомной массой 289,190(4) а. е. м.. Элемент сильно радиоактивен.
Изотоп водорода с 1 нейтроном
 | |
| Общие | |
|---|---|
| Символ | H |
| Имена | дейтерий, H-2, водород-2 |
| протоны | 1 |
| нейтроны | 1 |
| данные нуклидов | |
| естественное содержание | 0,0115% (земля) |
| масса изотопа | 2,01410177811 u |
| Спин | 1 |
| Избыточная энергия | 13135,720 ± 0,001 кэВ |
| Энергия связи | 2224,52 ± 0,20 кэВ |
| Изотопы водорода. Полная таблица нуклидов |
Дейтерий (или водород-2, символ . H. или . D., также известный как тяжелый водород ) является одним из двух стабильных изотопов водорода (другой — протий или водород-1). Ядро атома дейтерия , называемое дейтроном, содержит один протон и один нейтрон, тогда как гораздо более распространенный протий не имеет нейтронов в ядре. Дейтерий имеет естественное содержание в океанах Земли примерно один атом на 6420 водорода. Таким образом, дейтерий составляет примерно 0,02% (0,03% по массе) от всего природного водорода в океанах, в то время как на протий приходится более 99,98%. Содержание дейтерия незначительно меняется от одного вида природной воды к другому (см. Венская стандартная средняя океанская вода ).
Название дейтерий происходит от греческого deuteros, что означает «второй», для обозначения двух частиц, составляющих ядро. Дейтерий был открыт и назван в 1931 году Гарольдом Юри. Когда в 1932 году был открыт нейтрон, это сделало ядерную структуру дейтерия очевидной, и Юри получил Нобелевскую премию в 1934 году «за открытие тяжелого водорода». Вскоре после открытия дейтерия Юри и другие получили образцы «тяжелой воды », в которых содержание дейтерия было сильно концентрированным.
Дейтерий разрушается в недрах звезд быстрее, чем производится. Считается, что другие естественные процессы производят лишь незначительное количество дейтерия. Почти весь дейтерий, обнаруженный в природе, был произведен во время Большого взрыва 13,8 миллиарда лет назад, так как основное или изначальное соотношение водорода-1 к дейтерию (около 26 атомов дейтерия на миллион атомов водорода) происходит от то время. Это соотношение наблюдается у планет газовых гигантов, таких как Юпитер. Анализ отношений дейтерия и протия в кометах показал, что результаты очень похожи на среднее отношение в океанах Земли (156 атомов дейтерия на миллион атомов водорода). Это подкрепляет теории о том, что большая часть океанской воды Земли имеет кометное происхождение. Отношение дейтерия к протию кометы 67P / Чурюмов-Герасименко, измеренное космическим зондом Rosetta, примерно в три раза больше, чем у земной воды. Это самый высокий показатель, когда-либо измеренный для кометы.
Соотношение дейтерия и протия, таким образом, продолжает оставаться активной темой исследований как в астрономии, так и в климатологии.
Содержание
- 1 Отличия от обычного водорода (протия)
- 1.1 Химический символ
- 1.2 Спектроскопия
- 1.3 Нуклеосинтез Большого взрыва
- 1.4 Изобилие
- 1.5 Производство
- 2 Свойства
- 2.1 Физические свойства
- 2.2 Квантовые свойства
- 2.3 Ядерные свойства (дейтрон)
- 2.3.1 Масса и радиус дейтрона
- 2.3.2 Спин и энергия
- 2.3.3 Изоспиновое синглетное состояние дейтрон
- 2.3.4 Приближенная волновая функция дейтрона
- 2.3.5 Магнитные и электрические мультиполи
- 3 Приложения
- 3.1 Ядерные реакторы
- 3.2 Спектроскопия ЯМР
- 3.3 Отслеживание
- 3.4 Контрастные свойства
- 3.5 Ядерное оружие
- 3.6 Лекарства
- 3.7 Усиленные основные питательные вещества
- 3.8 Термостабилизация
- 3.9 Замедление циркадных колебаний
- 4 История болезни
- 4.1 Подозрение на более легкие изотопы элементов
- 4.2 Обнаружен дейтерий
- 4.3 Название изотопа и Нобелевская премия
- 4.4 Эксперименты с «тяжелой водой» во время Второй мировой войны
- 4.5 В термоядерном оружии
- 4.6 Современные исследования
- 5 D ата для элементарного дейтерия
- 6 Антидейтерий
- 7 См. также
- 8 Ссылки
- 9 Внешние ссылки
Отличия от обычного водорода (протия)
Химический символ
 Дейтерий газоразрядная трубка
Дейтерий газоразрядная трубка
дейтерий часто обозначается химическим символом D. Поскольку это изотоп водорода с массовым числом 2, он также представлен как. H.. IUPAC допускает использование как D, так и. H., хотя. H. является предпочтительным. Для удобства используется отчетливый химический символ, поскольку изотоп широко используется в различных научных процессах. Кроме того, его большая разница в массах с протием (H) (дейтерий имеет массу 2,014102 u, по сравнению со средним водородом атомным весом 1,007947 ед., а масса протия 1,007825 ед.) дает немалые химические различия с протийсодержащими соединениями, тогда как массовые отношения изотопов в других химических элементах в этом отношении в значительной степени незначительны.
Спектроскопия
В квантовой механике уровни энергии электронов в атомах зависят от приведенной массы системы электрона и ядра. Для атома водорода роль приведенной массы наиболее просто видна в модели Бора атома, где приведенная масса появляется в простом вычислении постоянной Ридберга. и уравнение Ридберга, но приведенная масса также появляется в уравнении Шредингера и уравнении Дирака для расчета уровней энергии атомов.
Приведенная масса системы в этих уравнениях близка к массе отдельного электрона, но отличается от нее на небольшую величину, примерно равную отношению массы электрона к атомному ядру. Для водорода это количество составляет примерно 1837/1836, или 1.000545, а для дейтерия еще меньше: 3671/3670, или 1.0002725. Таким образом, энергии спектральных линий дейтерия и легкого водорода (водород-1 ) различаются на соотношение этих двух чисел, которое составляет 1.000272. Длины волн всех спектральных линий дейтерия короче соответствующих линий легкого водорода в 1.000272 раз. В астрономических наблюдениях это соответствует синему доплеровскому смещению, в 0,000272 раза превышающему скорость света, или 81,6 км / с.
Различия гораздо более заметны в колебательной спектроскопии, такой как инфракрасная спектроскопия и спектроскопия комбинационного рассеяния, а также во вращательных спектрах, таких как микроволновая спектроскопия, потому что приведенная масса дейтерия заметно выше, чем у протия. В спектроскопии ядерного магнитного резонанса дейтерий имеет очень другую частоту ЯМР (например, 61 МГц, когда протий находится на частоте 400 МГц) и гораздо менее чувствителен. Дейтерированные растворители обычно используются в протиевом ЯМР, чтобы предотвратить перекрытие растворителя с сигналом, хотя дейтериевый ЯМР сам по себе также возможен.
Нуклеосинтез Большого взрыва
Считается, что дейтерий сыграл важную роль в определении количества и соотношений элементов, которые образовались в результате Большого взрыва. Комбинируя термодинамику и изменения, вызванные космическим расширением, можно вычислить долю протонов и нейтронов на основе температуры в точке, в которой Вселенная остыла достаточно, чтобы позволить образование ядер. Этот расчет показывает семь протонов на каждый нейтрон в начале нуклеогенеза, соотношение, которое останется стабильным даже после завершения нуклеогенеза. Первоначально эта доля была в пользу протонов, прежде всего потому, что меньшая масса протона способствовала их образованию. По мере расширения Вселенная остывала. Свободные нейтроны и протоны менее стабильны, чем ядра гелия, а у протонов и нейтронов была веская энергетическая причина для образования гелия-4. Однако для образования гелия-4 требуется промежуточный этап образования дейтерия.
В течение большей части нескольких минут после Большого взрыва, во время которых мог произойти нуклеосинтез, температура была достаточно высокой, чтобы средняя энергия, приходящаяся на одну частицу, была больше, чем энергия связи слабосвязанного дейтерия; поэтому любой образовавшийся дейтерий немедленно разрушался. Эта ситуация известна как узкое место дейтерия . Узкое место задерживало образование любого гелия-4 до тех пор, пока Вселенная не остыла настолько, что образовался дейтерий (примерно при температуре, эквивалентной 100 кэВ). В этот момент произошел внезапный всплеск образования элементов (сначала дейтерий, который немедленно слился с гелием). Однако вскоре после этого, через двадцать минут после Большого взрыва, Вселенная стала слишком холодной для дальнейшего ядерного синтеза и нуклеосинтеза. К этому моменту содержания элементов были почти фиксированными, с единственным изменением, так как некоторые из радиоактивных продуктов нуклеосинтеза Большого взрыва (такие как тритий ) распадались. Дейтерий-узкое место в образовании гелия вместе с отсутствием стабильных способов соединения гелия с водородом или с самим собой (стабильных ядер с массовыми числами пять или восемь) означало, что незначительное количество углерода или каких-либо элементов тяжелее углерода, образовавшегося в результате Большого взрыва. Таким образом, эти элементы требовали образования звезд. В то же время, отказ от значительной части нуклеогенеза во время Большого взрыва гарантировал, что в более поздней Вселенной будет достаточно водорода, доступного для образования долгоживущих звезд, таких как наше Солнце.
Изобилие
Дейтерий в следовых количествах встречается в природе в виде дейтерия газ, записывается. H. 2или D 2, но наиболее естественным образом встречается в Вселенная связана с типичным атомом. H., газом, называемым дейтеридом водорода (HD или. H.. H.).
Существование дейтерия на Земле, в другом месте Солнечной системы (что подтверждено планетными зондами) и в спектрах звезд, также является важным элементом космологии. Гамма-излучение от обычного ядерного синтеза диссоциирует дейтерий на протоны и нейтроны, и нет никаких известных естественных процессов, кроме нуклеосинтеза Большого взрыва, которые могли бы произвести дейтерий в количестве, близком к его наблюдаемому естественному содержанию. Дейтерий образуется в результате редкого распада кластера и случайных поглощение естественных нейтронов легким водородом, но это тривиальные источники. Считается, что внутри Солнца и других звезд мало дейтерия, так как при этих температурах реакции ядерного синтеза с потреблением дейтерия происходят намного быстрее, чем протон-протонная реакция, в результате которой образуется дейтерий. Однако дейтерий сохраняется во внешней атмосфере Солнца в примерно той же концентрации, что и на Юпитере, и это, вероятно, не изменилось с момента возникновения Солнечной системы. Естественное содержание дейтерия, по-видимому, очень похоже на долю водорода, где бы водород ни находился, если только не работают очевидные процессы, которые его концентрируют.
Существование дейтерия с низкой, но постоянной первичной долей во всем водороде — еще один аргумент в пользу теории Большого взрыва над теорией устойчивого состояния Вселенной. Наблюдаемое соотношение водорода, гелия и дейтерия во Вселенной трудно объяснить, кроме как с помощью модели Большого взрыва. По оценкам, содержание дейтерия существенно не изменилось с момента его образования около 13,8 миллиарда лет назад. Измерения галактического дейтерия в Млечном Пути с помощью ультрафиолетового спектрального анализа показывают соотношение целых 23 атомов дейтерия на миллион атомов водорода в невозмущенных газовых облаках, что всего на 15% ниже оценочного первоначального отношения WMAP, равного примерно 27 атомов на миллион от Большого взрыва. Это было интерпретировано как означающее, что при звездообразовании в нашей галактике было разрушено меньше дейтерия, чем ожидалось, или, возможно, дейтерий был восполнен за счет большого поступления первичного водорода из-за пределов галактики. В космосе в нескольких сотнях световых лет от Солнца содержание дейтерия составляет всего 15 атомов на миллион, но на это значение предположительно влияет дифференциальная адсорбция дейтерия на зернах углеродной пыли в межзвездном пространстве.
Содержание дейтерия в межзвездном пространстве. Атмосфера Юпитера была напрямую измерена космическим зондом Galileo как 26 атомов на миллион атомов водорода. Наблюдения ISO-SWS обнаружили 22 атома на миллион атомов водорода в Юпитере. и это изобилие, как полагают, соответствует соотношению, близкому к изначальной солнечной системе. Это примерно 17% земного отношения дейтерия к водороду, составляющего 156 атомов дейтерия на миллион атомов водорода.
Кометные тела, такие как Комета Хейла-Боппа и Комета Галлея, как было измерено, содержат относительно больше дейтерия (около 200 атомов D на миллион водородов), соотношение, которое обогащены предполагаемым соотношением протосолнечной туманности, вероятно, из-за нагрева, и которые аналогичны отношениям, обнаруженным в морской воде Земли. Недавнее измерение содержания дейтерия в 161 атоме D на миллион водорода в комете 103P / Hartley (бывший объект пояса Койпера ), соотношение почти точно такое же, как в океанах Земли, подчеркивает теорию что поверхностные воды Земли могут образовываться в основном из комет. Совсем недавно отношение дейтерия к протию (D – H) 67P / Чурюмова-Герасименко, измеренное Розеттой, примерно в три раза больше, чем у земной воды, и это высокий показатель. Это вызвало новый интерес к предположениям о том, что вода на Земле может иметь частично астероидное происхождение.
Концентрация дейтерия выше среднего солнечного содержания на других планетах земной группы, в частности на Марсе и Венере.
Производство
Дейтерий производят для промышленных, научных и военных целей, начиная с обычной воды, небольшую часть которой составляет природная тяжелая вода, а затем отделение тяжелой воды с помощью сульфидного процесса Гирдлера, дистилляции или других методов.
Теоретически дейтерий для тяжелой воды можно было бы создать в ядерном реакторе, но отделение от обычной воды — самый дешевый массовый производственный процесс.
Ведущим поставщиком дейтерия в мире была компания Atomic Energy of Canada Limited до 1997 года, когда была остановлена последняя установка по производству тяжелой воды. Канада использует тяжелую воду в качестве замедлителя нейтронов для работы реактора CANDU.
Еще одним крупным производителем тяжелой воды является Индия. Все атомные электростанции Индии, кроме одной, представляют собой установки с тяжелой водой под давлением, которые используют природный (то есть необогащенный) уран. В Индии восемь заводов по производству тяжелой воды, семь из которых находятся в эксплуатации. Шесть установок, пять из которых находятся в эксплуатации, основаны на обмене D – H в газообразном аммиаке. Два других завода извлекают дейтерий из природной воды в процессе, в котором используется сероводород под высоким давлением.
В то время как Индия обеспечивает себя тяжелой водой для собственных нужд, Индия теперь также экспортирует тяжелую воду реакторного качества.
Свойства
Физические свойства
Физические свойства соединений дейтерия могут проявлять значительные кинетические изотопные эффекты и другие физические и химические отличия свойств от аналогов протия. D2O, например, более вязкий, чем H2O. В химическом отношении существуют различия в энергии и длине связи для соединений тяжелых изотопов водорода по сравнению с протием, которые больше, чем изотопные различия в любом другом элементе. Связи с участием дейтерия и трития несколько прочнее, чем соответствующие связи в протии, и этих различий достаточно, чтобы вызвать значительные изменения в биологических реакциях. Фармацевтические фирмы заинтересованы в том, что дейтерий сложнее удалить из углерода, чем протий.
Дейтерий может заменить протий в молекулах воды с образованием тяжелой воды (D 2 O), что примерно соответствует На 10,6% плотнее обычной воды (так, что лед из нее тонет в обычной воде). Тяжелая вода слабо токсична для эукариотических животных, при этом 25% замещение воды в организме вызывает проблемы с делением клеток и бесплодие, а замещение 50% вызывает смерть от цитотоксического синдрома (недостаточность костного мозга и нарушение слизистой оболочки желудочно-кишечного тракта). Прокариотические организмы, однако, могут выжить и расти в чистой тяжелой воде, хотя и развиваются медленно. Несмотря на эту токсичность, потребление тяжелой воды при нормальных обстоятельствах не представляет угрозы здоровью для людей. Подсчитано, что человек весом 70 кг (154 фунта) может выпить 4,8 литра (1,3 галлона США) тяжелой воды без серьезных последствий. Небольшие дозы тяжелой воды (несколько граммов для людей, содержащие количество дейтерия, сравнимое с тем, которое обычно присутствует в организме) обычно используются в качестве безвредных метаболических индикаторов для людей и животных.
Квантовые свойства
Дейтрон имеет спин +1 («триплетное состояние ») и, таким образом, является бозоном. Частота ЯМР дейтерия значительно отличается от частоты обычного легкого водорода. Инфракрасная спектроскопия также легко дифференцирует многие дейтерированные соединения из-за большой разницы в частоте ИК-поглощения, наблюдаемой при колебании химической связи, содержащей дейтерий, по сравнению с легким водородом. Два стабильных изотопа водорода можно также различить с помощью масс-спектрометрии.
. Триплетный дейтронный нуклон практически не связан при E B = 2,23 МэВ, и ни одно из состояний с более высокой энергией не связано. Синглетный дейтрон — это виртуальное состояние с отрицательной энергией связи ~ 60 кэВ. Такой стабильной частицы нет, но эта виртуальная частица временно существует во время неупругого рассеяния нейтрона и протона, что объясняет необычно большое сечение рассеяния нейтронов протоном.
Ядерные свойства (дейтрон)
Масса и радиус дейтрона
Ядро дейтерия называется дейтроном . Он имеет массу 2,013553212745 (40) u (чуть более 1,875 ГэВ).
зарядовый радиус дейтрона равен 2,12799 (74) fm.
Как и радиус протона , измерения с использованием мюонного дейтерия дают меньший результат: 2,12562 (78) fm.
Спин и энергия
Дейтерий является одним из пяти стабильных нуклидов с нечетное количество протонов и нечетное количество нейтронов. (. H., . Li., . B., . N., . Ta. ; также долгоживущие радиоактивные нуклиды . K., . V., . La., . Lu. встречаются в природе.) Большинство нечетно-нечетных ядер нестабильны в отношении бета-распада, потому что продукты распада четно-четное, и поэтому они более сильно связаны из-за эффектов ядерного спаривания. Дейтерий, однако, выигрывает от того, что его протон и нейтрон связаны со спином 1, что дает более сильное ядерное притяжение; соответствующее состояние со спином 1 не существует в двухнейтронной или двухпротонной системе из-за принципа исключения Паули, который требует, чтобы одна или другая идентичная частица с таким же спином имела другие квантовое число, такое как орбитальный угловой момент. Но орбитальный угловой момент любой частицы дает более низкую энергию связи для системы, в первую очередь из-за увеличения расстояния между частицами в крутомградиенте ядерной силы. В обоих случаях это приводит к тому, что дипротон и ядро динейтрона становятся нестабильными.
Протон и нейтрон, составляющие дейтерий, могут диссоциировать через нейтральный ток взаимодействует с нейтрино. сечение этого взаимодействия сравнительно велико, и дейтерий был успешно использован в качестве нейтринной мишени в эксперименте Нейтринной обсерватории Садбери.
Двухатомный дейтерий (D 2) имеет орто- и пара ядерные спиновые изомеры, такие как двухатомный водород, но с различиями в количестве и заселенности спиновых состояний и вращательные уровни, которые возникают потому, что дейтрон является бозоном с ядерным спином, равным единице.
Изоспиновое синглетное состояние дейтрона
Из-за сходства в массы и ядерных свойств между протоном и нейтроном, иногда их рассматривают как два симметричных типа одного и того же объекта, нуклона. Хотя только протон имеет электрический заряд, им часто можно пренебречь из-за слабости электромагнитного взаимодействия по сравнению с сильным ядерным взаимодействием. Симметрия, связывающая протон и нейтрон, известна как изоспин и обозначается I (или иногда T).
Изоспин — это симметрия SU (2), как и обычный спин, поэтому он полностью аналоген ему. Протон и нейтрон, каждый из которых имеет изо спин- ⁄ 2, образуют изоспиновый дублет (аналогичный спин-дублету ), при состоянии «вниз» (↓) является нейтрон и состояние «вверх »(↑) — протон. Пара нуклонов может находиться либо в антисимметричном состоянии изоспина, называемом синглет, либо в симметричном состоянии, называемом триплетом. С точки зрения состояния «вниз» и «вверх» синглет равен
- 1 2 (| ↑ ↓⟩ — | ↓ ↑⟩). { displaystyle { frac {1} { sqrt {2}}} { Big (} | { uparrow downarrow} rangle — | { downarrow uparrow} rangle { Big)}.}
, что также можно записать: 1 2 (| pn⟩ — | np⟩). { displaystyle { frac {1} { sqrt {2}}} { Big (} | pn rangle — | np rangle { Big)}.}
Это ядро с одним протоном и одним нейтрон, т.е. ядро дейтерия. Тройка:
- (| ↑↑⟩ 1 2 (| ↑ ↓⟩ + | ↓ ↑⟩) | ↓↓⟩) { displaystyle left ({ begin {array} {ll} | { uparrow uparrow} rangle \ { frac {1} { sqrt {2}}} (| { uparrow downarrow} rangle + | { downarrow uparrow} rangle) \ | { downarrow downarrow} rangle end {array}} right)}
и таким образом из трех типов ядер, которые считаются симметричными: ядро дейтерия (на самом деле его сильно возбужденное состояние ), ядро с двумя протонами и ядро с двумя нейтронами. Эти состояния нестабильны.
Приближенная волновая функция дейтрона
Волновая функция дейтрона должна быть антисимметричной, если используется изоспиновое представление (поскольку протон и нейтрон не являются идентичными частями, волновая функция в целом не должна быть антисимметричной). Помимо изоспина, два нуклона также имеют пространственное покрытие своей волновой функции. Последний является симметричным, если дейтрон является симметричным относительно четности четности (т.е. имеет «четную» или «положительную» четность), и антисимметричным, если дейтрон антисимметричен относительно четности (т.е. имеет «нечетную») «паритет». Четкость полностью определена полным орбитальным угловым моментом двух нуклонов: если он четный, то четность четная (положительная), а если она нечетная, то четность нечетная (отрицательная).
Дейтрон, будучи изоспиновым синглетом, антисимметричным по отношению к изоспинам и, следовательно, должен быть симметричным по отношению к двойному обмену их спина и местоположения. Следовательно, он может находиться в одном из следующих двух различных состояний:
- Симметричный обмен В этом случае обмен двумя нуклонами умножит функцию функции дейтерия на (-1) из-за изоспинового обмена, (+1) из-за спинового обмена и (+1) из-за четности. (обмен местоположения), в общей сложности (-1) по необходимости для антисимметрии.
- Антисимметричный спин и антисимметричный по четности. В этом случае обмен двумя нуклонами умножит волновую функцию дейтерия на (-1) из-за изоспинового обмена, (-1) из-за спинового обмена и (-1) из-за четности (обмен местоположения), снова в сумме (- 1)) для антисимметрии.
В первом случае дейтрон представляет собой спиновый триплет, так что его полный спин s равен 1. Он также имеет четную четность и, следовательно, орбитальный угловой момент l; Чем меньше его орбитальный угловой момент, тем меньше его энергия. Следовательно, состояние с наименьшей возможной энергией имеет s = 1, l = 0.
Во втором случае дейтрон является спиновым синглетом, так что его полный спин s равен 0. Он также имеет нечетную четность и, следовательно, нечетный орбитальный угловой момент l. Следовательно, самое низко возможное энергетическое состояние имеет s = 0, l = 1.
Время s = 1 дает более сильное ядерное притяжение, первое состояние дейтерия находится в s = 1, l = 0 состояние.
Те же соображения приводят к возможным состояниям триплета изоспина, имеющего s = 0, l = четное или s = 1, l = нечетное. Таким образом, состояние с наименьшей энергией имеет s = 1, l = 1, что выше, чем у изоспинового синглета.
Только что приведенный анализ на самом деле является лишь приблизительным, потому что изоспин не является точной симметрией, и, что более важно, потому что сильное ядерное взаимодействие между двумя нуклонами связано с угловой импульс в спин-орбитальное взаимодействиеии, которое смешивает различные s- и l-состояния. То есть s и l непостоянны во времени (они не коммутируют с гамильтонианом ), и со временем такое состояние, как s = 1, l = 0, может стать состоянием s = 1, l = 2. Четность остается постоянной во времени, поэтому они не смешиваются с нечетными l состояниями (такими как s = 0, l = 1). Следовательно, квантовое состояние дейтерия является суперпозицией (линейной комбинацией) состояния s = 1, l = 0 и состояния s = 1, l = 2, даже хотя первый компонент намного больше. Всегда полный угловой момент j также является хорошим квантовым числом (это постоянная во времени), оба компонента должны иметь одинаковый j, и поэтому j = 1. Это полный спин ядра дейтерия.
Подводя итог, ядро дейтерия антисимметрично по изоспину, имеет спин 1 и четность (+1). Относительный угловой момент его нуклонов не определен должным образом, и дейтрон представляет собой суперпозицию в основном l = 0 с некоторыми l = 2.
Магнитный и электрический мультиполи
найти теоретически дейтерий магнитный дипольный момент μ, используется формула для ядерного магнитного момента
- μ = 1 j + 1 ⟨(l, s), j, mj = j | μ → ⋅ ȷ → | (l, s), j, mj знак равно J⟩ { displaystyle mu = { frac {1} {j + 1}} { bigl langle} (l, s), j, m_ {j} { =} j , { bigr |} , { vec { mu}} cdot { vec { jmath}} , { bigl |} , (l, s), j, m_ {j } {=} j { bigr rangle}}
с
- μ → = g (l) l → + g (s) s → { displaystyle { vec { mu}} = g ^ { (l)} { vec {l}} + g ^ {(s)} { vec {s}}}
g и g являются g-факторами нуклонов.
Есть разные значения протон и нейтрон имеют разные значения для g и g, необходимо разделить их вклады. Каждый получает половину орбитального углового момента дейтерия l → { displaystyle { vec {l}}}

- μ = 1 j + 1 ⟨(l, s), j, m j = j | (1 2 l → g (l) p + 1 2 s → (g (s) p + g (s) n)) ⋅ ȷ → | (l, s), j, mj = j { displaystyle mu = { frac {1} {j + 1}} { Bigl langle} (l, s), j, m_ {j} {=} j , { Bigr |} left ({ frac {1} {2}} { vec {l}} {g ^ {(l)}} _ {p} + { frac {1} {2 }} { vec {s}} ({g ^ {(s)}} _ {p} + {g ^ {(s)}} _ {n}) right) cdot { vec { jmath} } , { Bigl |} , (l, s), j, m_ {j} {=} j { Bigr rangle}}
где нижние индексы p и n обозначают протон и нейтрон, а g n = 0.
Используя те же идентификаторы, что и здесь, и используя значение g p = 1 μN, мы приходим к следующему результату, в единицах ядерных магнетонов
- μ = 1 4 (j + 1) [(g (s) p + g (s) n) (j (j + 1) — l (l + 1)) + s (s + 1)) + (j (j + 1) + l (l + 1) — s (s + 1))] { displaystyle mu = { frac {1} {4 (j + 1)}} left [({g ^ {(s)}} _ {p} + {g ^ {(s)}} _ {n}) { big (} j (j + 1) — l ( l + 1) + s (s + 1) { big)} + { big (} j (j + 1) + l (l + 1) -s (s + 1) { big)} right] }
Для состояний s = 1, l = 0 (j = 1) мы получаем
- μ = 1 2 (г (s) p + g (s) n) = 0,879 { displaystyle mu = { frac {1} {2}} ({g ^ {(s)}} _ {p} + {g ^ {(s)}} _ {n}) = 0,879}
Для состояний s = 1, l = 2 (j = 1) получаем
- μ = — 1 4 (g (s) p + g ( s) n) + 3 4 = 0,310 { displaystyle mu = — { frac {1} {4}} ({g ^ {(s)}} _ {p} + {g ^ {(s)}} _ {n}) + { frac {3} {4}} = 0,310}
Измеренное значение дейтерия магнитного дипольного момента составляет 0,857 мкН, что составляет 97,5% от значения 0,879 мкН, полученного сложным моментом протона и нейтрона. Это говорит о том, что состояние дейтерия действительно в хорошем приближении s = 1, l = 0 состояние, которое возникает, когда оба нуклона вращаются в одном направлении, но их магнитные моменты вычитаются из-за отрицательного момента нейтрона.
Но немного меньшее экспериментальное число, которое получается в результате простого сложения протонного и (отрицательного) нейтронного моментов, показывает, что дейтерий на самом деле является линейной комбинацией в основном состояния s = 1, l = 0 с небольшой примесью s = 1, l = 2 состояние.
электрический диполь равенство нулю как обычно.
Измеренный электрический квадруполь дейтерия равен 0,2859 e ·fm. Поскольку радиус дейтерия составляет порядок 1 фемтометра (см. Ниже), его электрический заряд равен e, хотя вышеуказанная модель не подходит для ее расчета. Более конкретно, электрический квадруполь не получает вклада от состояния l = 0 (которое является доминирующим) и действительно получает вклад от члена, смешивающего состояния l = 0 и l = 2, поскольку электрический квадрупольный оператор не имеет углового момента.
. Последний вклад является доминирующим при отсутствии чистого вклада l = 0, но не может быть вычислен без точной пространственной формы нуклоны волновая функция внутри дейтерия.
Более высокие магнитные и электрические моменты мультипольные моменты не могут быть рассчитаны с помощью вышеуказанной модели по аналогичным причинам.
Приложения
Дейтерий имеет ряд коммерческих и научных применений. К ним относ:
Ядерные реакторы
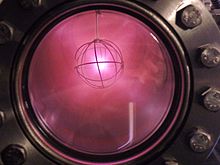
Дейтерий используется в реакторах деления с тяжеловодным замедлителем, обычно в виде жидкого D 2 O, для замедления нейтронов высокого поглощения нейтронов, как у обычного водорода. Это обычное коммерческое использование больших количеств дейтерия.
В исследовательских реакторах жидкий D 2 используется для смягчения нейтронов до очень низких энергий и длинных, подходящих для экспериментов по рассеянию.
Экспериментально дейтерий распространенным нуклидом, используемым в конструкциях реакторов ядерного синтеза, особенно в наиболее сочетании с тритием, из-за большой скорости реакции (или сечение ядра ) и высокого энергия выход D — Модель реакции. Существует еще более высокопроизводительная реакция слияния D– . He., хотя точка безубыточности для D–. He. выше, чем у других эффектов слияния; вместе с нехваткой. He., это делает его неприемлемым в качестве практического источника энергии до тех пор, пока по крайней мере, реакции синтеза D — T и D — D не будут выполнены в промышленном масштабе. Коммерческий ядерный синтез еще не реализован.
ЯМР-спектроскопия
 Спектр излучения ультрафиолетовой дейтериевой дуговой лампы
Спектр излучения ультрафиолетовой дейтериевой дуговой лампы
Дейтерий наиболее часто используется в водородной спектроскопии ядерного магнитного резонанса (протон ЯМР ) следующим образом. ЯМР обычно требует, чтобы интересующие соединения анализировались как растворенные в растворе. Из-за ядерных спиновых свойств дейтерия, которые отличаются от легкого водорода, обычно присутствующего в органических молекулах, спектры ЯМР водорода / протия сильно отличаются от спектров дейтерия, и на практике дейтерий не «виден» прибором ЯМР, настроенным на легкий водород.. Поэтому дейтерированные растворители (включая тяжелую воду, а также такие соединения, как дейтерированный хлороформ, CDCl 3) обычно используются в ЯМР-спектроскопии, чтобы позволить измерять только спектры легкого водорода интересующего соединения. без помех сигнала растворителя.
Спектроскопия ядерного магнитного резонанса также может использоваться для получения информации об окружении дейтрона в меченных изотопами образцах (ЯМР дейтерия ). Например, гибкость хвоста, представляющего собой длинную углеводородную цепь, в молекулах липидов, меченных дейтерием, может быть количественно определена с помощью твердотельного ЯМР дейтерия.
Спектры ЯМР дейтерия особенно информативны в твердом состоянии из-за его относительно небольшой квадрупольный момент по сравнению с квадрупольными ядрами большего размера, например, с хлором-35.
Отслеживание
В химии, биохимии и науках об окружающей среде дейтерий используется как нерадиоактивный, стабильный изотопный индикатор, например, в тесте на воду с двойной меткой. В химических реакциях и метаболических путях дейтерий ведет себя несколько аналогично обычному водороду (с некоторыми химическими различиями, как отмечалось). Его легче всего отличить от обычного водорода по его массе с помощью масс-спектрометрии или инфракрасной спектрометрии. Дейтерий может быть обнаружен с помощью фемтосекундной инфракрасной спектроскопии, поскольку разница масс сильно влияет на частоту молекулярных колебаний; Колебания связи дейтерий-углерод обнаруживаются в спектральных областях, свободных от других сигналов.
Измерения небольших вариаций естественного содержания дейтерия, наряду с измерениями стабильных тяжелых изотопов кислорода O и O, имеют важное значение в гидрологии, чтобы проследить географическое происхождение вод Земли.. Тяжелые изотопы водорода и кислорода в дождевой воде (так называемая метеорная вода ) обогащаются в зависимости от температуры окружающей среды региона, в котором выпадают осадки (и, таким образом, обогащение связано со средней широтой). Относительное обогащение тяжелыми изотопами в дождевой воде (по отношению к средней воде океана) при отображении в зависимости от температуры предсказуемо падает по линии, называемой глобальной линией метеорной воды (GMWL). Этот график позволяет идентифицировать образцы воды, образовавшейся в результате атмосферных осадков, а также общую информацию о климате, в котором они возникли. Процессы испарения и другие процессы в водоемах, а также процессы в грунтовых водах также по-разному изменяют соотношения тяжелых изотопов водорода и кислорода в пресных и соленых водах характерными и часто регионально различимыми способами. Отношение концентраций H к H обычно обозначается дельтой как δH, и географические закономерности этих значений нанесены на карты, называемые изоскопами. Стабильные изотопы входят в состав растений и животных, и анализ соотношений у перелетных птиц или насекомых может помочь предложить приблизительное руководство к их происхождению.
Контрастные свойства
Методы рассеяния нейтронов особенно выигрывают от наличие дейтерированных образцов: сечения H и D очень четкие и различаются по знаку, что позволяет варьировать контраст в таких экспериментах. Кроме того, неприятной проблемой обычного водорода является его большое некогерентное нейтронное сечение, которое равно нулю для D. Таким образом, замена атомов водорода атомами дейтерия снижает шум рассеяния.
Водород — важный компонент во всех материалах органической химии и наук о жизни, но он почти не взаимодействует с рентгеновскими лучами. В биологии и многих других областях используются методы рассеяния нейтронов вместе с современной установкой дейтерия, заполняют нишу во многих исследованиях макромолекул в биологии и многих других областях.
Ядерное оружие
Это обсуждается ниже. Примечательно, что, хотя большинство звезд, включая Солнце, генерируют энергию на большей части своей жизни, превращая водород в более тяжелые элементы, такой синтез легкого водорода (протия) никогда не был успешным в условиях, достижимых на Земле. Таким образом, весь искусственный синтез, который происходит в так называемом синтезе водородных бомб, требует того, чтобы этот процесс работал в организме человека.
Лекарственные препараты
Дейтерированное лекарственное средство — это низкомолекулярный лекарственный препарат, в котором один или несколько элементов водорода, сися в молекуле лекарственного средства, были заменен дейтерием. Из-за кинетического изотопного эффекта дейтерийсодержащие препараты могут иметь значительно более низкие скорости метаболизма и, следовательно, более длительный период полувыведения. В 2017 г. дейтетрабеназин первым стал дейтерированным препаратом, получившим одобрение FDA.
Усиленные основные питательные вещества
Дейтерий можно использовать для усиления определенных уязвимых окислительных связей CH в основных или условно незаменимые питательные вещества, такие как источники аминокислоты или полиненасыщенные жирные кислоты (ПНЖК), что делает их более устойчивыми к окислительному повреждению. Дейтерированные полиненасыщенные жирные кислоты, такие как линолевая кислота, замедляют цепную реакцию перекисного окисления липидов, которая повреждает живые клетки. Дейтерированный этиловый эфир линолевой кислоты (RT001 ), шаблон Retrotope, проходит испытание в отношении сострадательного использования при детской нейроаксональной дистрофии и успешно завершил фазу I / II испытание атаксии Фридрейха.
Термостабилизация
Живые вакцины, такие как пероральная полиовакцина, могут быть стабилизированы дейтерием, отдельно или в сочетании с другими стабилизаторами, такими как MgCl 2.
Замедление циркадных колебаний
Было показано, что дейтерий удлиняет периодические колебания циркадных часов при дозировании у крыс, хомяков и динофлагеллят Gonyaulax. У крыс хроническое потребление 25% D 2 O нарушает циркадную ритмичность за счет удлинения циркадного периода супрахиазматических ядер -зависимых ритмов в гипоталамусе мозга. Эксперименты на хомяках также подтверждают теорию о том, что дейтерий воздействует на супрахиазматическое ядро , удлиняя свободный циркадный период.
История
Подозрение на более легкие изотопы элементов
Существование нерадиоактивных изотопов более легких элементов подозревалось вх неона еще в 1913 году и подтверждено масс-спектрометрией исследования легких элементов в 1920 году. Преобладающая теория в то время заключалась в том, что изотопы элемента различаются наличие дополнительных протонов в ядре, сопровождаемых таким же количеством ядерных электронов. Согласно этой теории, ядро дейтерия с массой два и зарядом один будет содержать два протона и один ядерный электрон. Однако ожидалось, что элемент водород с измеренной средней атомной массой, очень близкой к 1 u, известной массе протона, всегда имеет ядро, состоящее из одного протона (известной частицы), и не может содержать второй протон.. Таким образом, считалось, что водород не содержит тяжелых изотопов.
Обнаружен дейтерий
 Гарольд Юри, первооткрыватель дейтерия
Гарольд Юри, первооткрыватель дейтерия
Впервые он был обнаружен спектроскопически в конце 1931 года Гарольдом Ури, химиком из Колумбийского университета. Сотрудник Юри, Фердинанд Брикведд, дистиллировал пять литров криогенно произведенного жидкого водорода до 1 мл. жидкости, используя лабораторию низкотемпературной физики, которая недавно была создана при Национальном бюро стандартов в Вашингтоне, округ Колумбия (ныне Национальный институт стандартов и технологий ). Ранее этот метод использовался для выделения тяжелых изотопов неона. Метод криогенного испарения сконцентрировал фракцию изотопа водорода с массой 2 до такой степени, что его спектроскопическая идентификация была однозначной.
Название изотопа и Нобелевская премия
Юри придумал названия протий, дейтерий и тритий в статье, опубликованной в 1934 году. Название частично основано на рекомендациях Г. Н. Льюис, предложивший название «дейтиум». Название происходит от греческого deuteros («второй»), а ядро следует называть «дейтрон» или «дейтон». Изотопам и новым элементам традиционно давали имя, которое решил их первооткрыватель. Некоторые британские ученые, такие как Эрнест Резерфорд, хотели, чтобы изотоп был назван «диплогеном» от греческого слова diploos («двойной»), а ядро - «диплоном».
Количество, предполагаемое для нормального содержания этого тяжелого изотопа водорода, было настолько малым (всего около 1 атома на 6400 атомов водорода в океанской воде (156 дейтерия на миллион водородов)), что не оказало заметного влияния на предыдущие измерения (среднего) атомного водорода. масса. Это объясняло, почему раньше об этом не подозревали. Юри смог сконцентрировать воду, чтобы показать частичное обогащение дейтерием. Льюис приготовил первые образцы чистой тяжелой воды в 1933 году. Открытие дейтерия, предшествовавшее открытию нейтрона в 1932 году, было экспериментальным шоком для теории, но когда сообщалось о нейтроне, дейтерий Существование более объяснимо, дейтерий принес Юри Нобелевскую премию по химии в 1934 году. Льюис был озлоблен тем, что его обошли стороной за это признание, данное его бывшему ученику.
Эксперименты с «тяжелой водой» в мире Вторая война
Незадолго до войны Ханс фон Хальбан и Лью Коварски переместили свои исследования замедления нейтронов из Франции в Великобританию, переправив все мировые запасы тяжелой воды. (который был произведен в Норвегии) в двадцати шести стальных барабанах.
Во время Второй мировой войны нацистская Германия, как было известно, проводила эксперименты с использованием тяжелой воды в качестве замедлителя проекта ядерного реактора. Такие эксперименты вызвали беспокойство, потому что они могли позволить им производить плутоний для атомной бомбы. В конечном итоге это привело к операции союзников под названием «норвежский саботаж тяжелой воды », целью которой было уничтожение Веморк завода по производству / обогащению дейтерия в Норвегии.. В то время это считалось важным для потенциального прогресса войны.
После окончания Второй мировой войны союзники обнаружили, что Германия не вкладывает столько серьезных усилий в программу, как предполагалось ранее. Они не смогли выдержать цепную реакцию. Немцы построили только небольшой, частично построенный экспериментальный реактор (который был спрятан). К концу войны у немцев не было даже пятой части тяжелой воды, необходимой для работы реактора, отчасти из-за норвежской диверсионной операции с тяжелой водой. Однако даже если бы немцам удалось запустить реактор (как это сделали США с графитовым реактором в конце 1942 г.), им все равно оставалось бы по крайней мере несколько лет до разработки атомной бомбы с максимальным усилие. Процесс проектирования, даже с максимальными усилиями и финансированием, потребовал около двух с половиной лет (от первого критического реактора до бомбы), например, как в США, так и в СССР.
В термоядерном оружии
 Корпус устройства «Колбаса» Айви Майк водородной бомбы, прикрепленной к контрольно-измерительным приборам и криогенному оборудованию. В бомбе высотой 20 футов находилась криогенная колба Дьюара, вмещавшая 160 кг жидкого дейтерия.
Корпус устройства «Колбаса» Айви Майк водородной бомбы, прикрепленной к контрольно-измерительным приборам и криогенному оборудованию. В бомбе высотой 20 футов находилась криогенная колба Дьюара, вмещавшая 160 кг жидкого дейтерия.
62-тонное устройство Ivy Mike, построенное в США и взорвавшееся 1 ноября 1952 г. была создана первая полностью удачная «водородная бомба » (термоядерная бомба). В данном контексте это была первая бомба, в которой большая часть высвобожденной энергии пришла на стадии ядерной реакции, которые следовали за первичной стадией ядерного деления атомной бомбы. Бомба Айви Майк представляла собой фабричное здание, а не оружие, которое можно было доставить. В его центре очень большая цилиндрическая изолированная вакуумная колба или криостат, содержащая криогенный жидкий дейтерий в объеме примерно 1000 литров (Массой 160 килограммов, если этот объем был заполнен полностью). Затем обычная атомная бомба («первичная») на одном конце бомбы была использована для создания условий экстремальной температуры и давления, необходимых для запуска термоядерной реакции.
В течение нескольких лет были разработаны так называемые «сухие» водородные бомбы, для которых не требовался криогенный водород. Обнародованная информация свидетельствует о том, что все термоядерное оружие, созданное с тех пор, содержит химические соединения дейтерия и лития на вторичных стадиях. Материалом, содержащим дейтерий, в основном является дейтерид лития, при этом литий состоит из изотопа лития-6. Когда литий-6 бомбардируется быстрыми нейтронами атомной бомбы, образуется тритий (водород-3), а затем дейтерий и тритий быстро вступают в термоядерную термоядерный синтез, выделяющий много энергии, гелий-4 и даже больше свободных нейтронов.
Современные исследования
В августе 2018 года ученые объявили о преобразовании газообразного дейтерия в жидкую металлическую форму. Это может помочь исследователям лучше понять гигантские газовые планеты, такие как Юпитер, Сатурн и связанные с ними экзопланеты, поскольку считается, что такие планеты содержат много жидкого металлического водорода, который может быть ответственным за наблюдаемые мощные магнитные поля.
Данные для элементарного дейтерия
Формула: D 2 или . 1H. 2
- Плотность: 0,180 кг / м при STP ( 0 ° C, 101,325 кПа).
- Атомный вес: 2,0141017926 ед.
- Среднее содержание в океанской воде (из VSMOW ) 155,76 ± 0,1 частей на миллион (отношение 1 часть на примерно 6420 частей), то есть примерно 0,015% атомов в образце (по количеству, а не по массе)
Данные примерно при 18 К для D 2(тройной точки ):
- Плотность :
- Жидкость: 162,4 кг / м
- Газ: 0,452 кг / м
- Вязкость: 12,6 мкПа · с при 300 К (газовая фаза)
- Удельная теплоемкость при постоянном давлении c p:
- Твердое тело: 2950 Дж / (кг · К)
- Газ: 5200 Дж / (кг · К)
Антидейтерий
An антидейтрон — это антивещество аналог ядра дейтерия, состоящий из антипротона и антинейтрона. Антидейтрон был впервые произведен в 1965 году на протонном синхротроне в ЦЕРН и синхротроне с переменным градиентом в Брукхейвенской национальной лаборатории. Полный атом с позитроном, вращающимся вокруг ядра, будет называться антидейтерий, но по состоянию на 2019 год антидейтерий еще не был создан. Предлагаемый символ антидейтерия -. D., то есть D с чертой сверху.
См. Также
- Изотопы водорода
- Ядерный синтез
- Токамак
- Тритий
- Тяжелая вода
Ссылки
Внешние ссылки
| Найдите дейтерий в Викисловаре, бесплатном словаре. |
- Центр ядерных данных в KAERI
- »с аннотацией библиография по дейтерию ». ALSOS: Электронная библиотека по ядерным вопросам. Архивировано из оригинального 5 мая 2010 г. Получено 26 ноября 2019 г.
- Маллинс, Джастин (27 апреля 2005 г.). «Настольный ядерный синтез продемонстрирован». New Scientist.
- Ллойд, Робин (21 августа 2006 г.). «В Млечном Пути найден пропавший газ». Space.com.
.
| Дейтерий | |
|---|---|
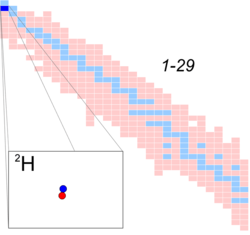 Таблица нуклидов | |
| Общие сведения | |
| Название, символ | Дейтерий, 2H |
| Альтернативные названия | тяжёлый водород, D |
| Нейтронов | 1 |
| Протонов | 1 |
| Свойства нуклида | |
| Атомная масса | 2,0141017778(4)[1] а. е. м. |
| Избыток массы | 13 135,7216(3)[1] кэВ |
| Удельная энергия связи (на нуклон) | 1 112,283(0)[1] кэВ |
| Изотопная распространённость | 0,0115(70) %[2] |
| Период полураспада | стабильный[2] |
| Спин и чётность ядра | 1+[2] |
Дейте́рий (лат. deuterium, от др.-греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 г. американским физико-химиком Г. Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Изотопные модификации соединений водорода
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C
- Температура кипения −249,5 °C
Содержание дейтерия в природном водороде — 0,0011-0,0016 ат.% [4].
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Мировое производство дейтерия — десятки тысяч тонн в год. Основные методы получения: многоступенчатый электролиз воды, ректификация воды, ионный обмен, ректификация аммиака. При электролизе 100л воды выделяется 7,5 мл 60%-ного D2O[5].
При длительном кипячении природной воды концентрация тяжёлой воды в ней повышается очень незначительно — в пределах 1 %[источник не указан 1070 дней]. Среди населения бытует миф о том, что это якобы может вредно сказаться на здоровье. В действительности же повышение концентрации тяжёлой воды при кипячении ничтожно, гораздо сильнее ощущается повышение концентрации растворённых солей.
Применение
Дейтерий широко используется в атомной энергетике как замедлитель нейтронов в атомных реакторах; в смеси с тритием или в соединении с литием-6 применяют для термоядерной реакции в водородных бомбах, применяется в качестве меченого стабильного индикатора в лабораторных исследованиях и технике. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER).
Примечания
- ↑ 1 2 3 G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 1 2 3 4 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.298
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.299
Литература
- Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.298-299
- Физическая энциклопедия. / Гл. ред. Прохоров А. М. — М.: Советская энциклопедия, 1988. — Т. 1.— 704 с., ил. — 100 000 экз.
| Изотопы водорода |
|---|
| Стабильные: 1H: Протий, D, 2H: Дейтерий 10—10 000 лет: T, 3H: Тритий Нестабильные (менее суток): 4H: Водород-4, 5H: Водород-5, 6H: Водород-6, 7H: Водород-7 см. также. Водород, Таблица нуклидов |
| | |||||
|---|---|---|---|---|---|
| Инженерия | Ядерная физика · Деление ядра · Термоядерная реакция · Излучение · Ионизирующее излучение · Атомное ядро · Ядерная безопасность · Ядерная химия | ||||
| Материалы | Ядерное топливо · Отработанное ядерное топливо · Ядерное топливное сырье · Торий · Уран (Обогащение урана • Обеднённый уран) · Плутоний · Дейтерий · Тритий | ||||
| Ядерная энергия |
| ||||
| Ядерная медицина |
| ||||
| Ядерное оружие | История · Разработка · Ядерная война · Ядерная гонка · Ядерный взрыв (Поражающие факторы ядерного взрыва) · Ядерное испытание · Перевозка · распространение |
|
|
 Изотоп дейтерия выделен в усеченной таблице нуклидов для атомных номеров от 1 до 29. Количество нейтронов начинается с нуля и увеличивается вниз. Количество протонов начинается с единицы и увеличивается вправо. Стабильные изотопы синим цветом. | |
| Общий | |
|---|---|
| Условное обозначение | 2 ч |
| Имена | дейтерий, H-2, водород-2, D |
| Протоны | 1 |
| Нейтронов | 1 |
| Данные о нуклидах | |
| Природное изобилие | 0,0156% (Земля) [1] |
| Изотопная масса | 2,01410177811 [2] u |
| Вращаться | 1 + |
| Избыточная энергия | 13135,720 ± 0,001 кэВ |
| Связующая энергия | 2224,52 ± 0,20 кэВ |
| Изотопы водорода Полная таблица нуклидов |
Дейтерий (или водород-2 , символ2
ЧАС
или
D
, Также известный как тяжелый водород ) является одним из двух изотопов стабильных из водорода (другой протии , или водорода-1). Ядро из дейтерия атома , называется дейтронами , содержит один протон и один нейтрон , в то время как гораздо более распространенной протия не имеет нейтронов в ядре. Дейтерий имеет естественное содержание в океанах Земли, составляющее около одного атома в6420 водорода. Таким образом, дейтерий составляет приблизительно 0,0156% (0,0312% по массе) от всего природного водорода в океанах, в то время как на протий приходится более 99,98%. Содержание дейтерия незначительно меняется от одного вида природной воды к другому (см. Венский стандарт средней океанской воды ).
Название дейтерий происходит от греческого deuteros , что означает «второй», для обозначения двух частиц, составляющих ядро. [3] Дейтерий был открыт и назван в 1931 году Гарольдом Юри . Когда в 1932 году был открыт нейтрон, это сделало ядерную структуру дейтерия очевидной, и Юри получил Нобелевскую премию в 1934 году «за открытие тяжелого водорода». Вскоре после открытия дейтерия Юри и другие получили образцы « тяжелой воды », в которых содержание дейтерия было сильно сконцентрировано.
Дейтерий разрушается в недрах звезд быстрее, чем производится. Считается, что другие естественные процессы производят лишь незначительное количество дейтерия. Почти весь дейтерий, обнаруженный в природе, был произведен во время Большого взрыва 13,8 миллиарда лет назад, поскольку основное или изначальное отношение водорода-1 к дейтерию (около 26 атомов дейтерия на миллион атомов водорода) возникло с того времени. Это соотношение наблюдается у планет газовых гигантов, таких как Юпитер. Анализ отношений дейтерия и протия в кометах показал результаты, очень похожие на среднее отношение в океанах Земли (156 атомов дейтерия на миллион атомов водорода). Это подкрепляет теории о том, что большая часть океанской воды Земли имеет кометное происхождение. [4] [5] Отношение дейтерия к протию кометы67P / Чурюмов-Герасименко , по данным космического зонда Rosetta , примерно в три раза больше земной воды. Это самый высокий показатель для кометы из когда-либо измеренных. [6]
Таким образом, отношения дейтерия и протия продолжают оставаться активной темой исследований как в астрономии, так и в климатологии.
Отличия от обычного водорода (протия) [ править ]
Химический символ [ править ]

Дейтерий часто обозначается химическим символом D. Поскольку это изотоп водорода с массовым числом 2, он также обозначается2
ЧАС
. ИЮПАК допускает как D, так и2
ЧАС
, несмотря на то что 2
ЧАС
является предпочтительным. [7] Для удобства используется отдельный химический символ, поскольку изотоп широко используется в различных научных процессах. Кроме того, его большая разница в массе с протием ( 1 H) (дейтерий имеет массу2,014 102 U , по сравнению с средним водорода с атомным весом от1,007 947 ед. , А масса протия составляет1.007 825 ед. ) Дает существенные химические различия с протийсодержащими соединениями, тогда как массовые отношения изотопов в других химических элементах в этом отношении в значительной степени незначительны.
Спектроскопия [ править ]
В квантовой механике уровни энергии электронов в атомах зависят от приведенной массы системы электрона и ядра. Для атома водорода роль приведенной массы наиболее просто видна в модели атома Бора , где приведенная масса появляется в простом вычислении постоянной Ридберга и уравнения Ридберга, но приведенная масса также появляется в уравнении Шредингера : и уравнение Дирака для расчета уровней энергии атомов.
Приведенная масса системы в этих уравнениях близка к массе отдельного электрона, но отличается от нее на небольшую величину, примерно равную отношению массы электрона к атомному ядру. Для водорода это количество составляет примерно 1837/1836, или 1.000545, а для дейтерия еще меньше: 3671/3670, или 1.0002725. Таким образом, энергии спектральных линий дейтерия и легкого водорода ( водорода-1 ) различаются соотношением этих двух чисел, которое составляет 1.000272. Длины волн всех спектральных линий дейтерия короче соответствующих линий легкого водорода в 1.000272 раз. В астрономических наблюдениях это соответствует синему доплеровскому смещению, в 0,000272 раза превышающему скорость света, или 81,6 км / с. [8]
Различия намного более выражены в колебательной спектроскопии , таких как ИК — спектроскопии и спектроскопии комбинационного рассеяния , [9] и в спектрах вращения , такие как СВЧ — спектроскопии , так как приведенная масса дейтерия заметно выше , чем у протия. В спектроскопии ядерного магнитного резонанса дейтерий имеет совершенно другую частоту ЯМР (например, 61 МГц, когда протий находится на частоте 400 МГц) и гораздо менее чувствителен. Дейтерированные растворители обычно используются в протиевом ЯМР, чтобы предотвратить перекрытие растворителя с сигналом, хотя дейтериевый ЯМР сам по себе также возможен.
Нуклеосинтез Большого взрыва [ править ]
Считается, что дейтерий сыграл важную роль в определении количества и соотношения элементов, образовавшихся в результате Большого взрыва . Комбинируя термодинамику и изменения, вызванные космическим расширением, можно вычислить долю протонов и нейтронов на основе температуры в точке, в которой Вселенная остыла достаточно, чтобы позволить образование ядер . Этот расчет показывает семь протонов на каждый нейтрон в начале нуклеогенеза , соотношение, которое останется стабильным даже после завершения нуклеогенеза. Первоначально эта доля была в пользу протонов, в первую очередь потому, что меньшая масса протона способствовала их образованию. По мере расширения Вселенная остывала.Свободные нейтроны и протоны менее стабильны, чем ядра гелия , а у протонов и нейтронов была веская энергетическая причина для образования гелия-4 . Однако для образования гелия-4 требуется промежуточный этап образования дейтерия.
В течение большей части нескольких минут после Большого взрыва, во время которых мог произойти нуклеосинтез, температура была достаточно высокой, так что средняя энергия, приходящаяся на одну частицу, была больше, чем энергия связи слабосвязанного дейтерия; поэтому любой образовавшийся дейтерий немедленно разрушался. Эта ситуация известна как « узкое место» по дейтерию . Узкое место задерживало образование любого гелия-4 до тех пор, пока Вселенная не стала достаточно холодной для образования дейтерия (примерно при температуре, эквивалентной 100 кэВ ). В этот момент произошел внезапный всплеск образования элементов (сначала дейтерий, который немедленно слился с гелием). Однако вскоре после этого, через двадцать минут после Большого взрыва, Вселенная стала слишком холодной для дальнейшего ядерного синтеза.и произойдет нуклеосинтез. К этому моменту содержание элементов было почти фиксированным, с единственным изменением, так как некоторые радиоактивные продукты нуклеосинтеза Большого взрыва (например, тритий ) распадались. [10] Дейтерий-узкое место в образовании гелия вместе с отсутствием стабильных способов соединения гелия с водородом или с самим собой (нет стабильных ядер с массовыми числами пять или восемь) означало, что незначительное количество углерода, или любые элементы тяжелее углерода, образовавшиеся в результате Большого взрыва. Таким образом, эти элементы требовали образования звезд. В то же время отказ от значительной степени нуклеогенеза во время Большого взрыва гарантировал, что в более поздней Вселенной будет достаточно водорода, доступного для образования долгоживущих звезд, таких как наше Солнце.
Изобилие [ править ]
Дейтерий происходит в следовых количествах в природе в виде дейтерий газа , написанный2
ЧАС
2 или D 2 , но большинство естественных атомов во Вселенной связаны типичными1
ЧАС
атом, газ, называемый дейтеридом водорода (HD или1
ЧАС
2
ЧАС
). [11]
Существование дейтерия на Земле, в других частях Солнечной системы (что подтверждено планетарными зондами) и в спектрах звезд также является важным элементом космологии . Гамма-излучение от обычного ядерного синтеза диссоциирует дейтерий на протоны и нейтроны, и нет никаких известных естественных процессов, кроме нуклеосинтеза Большого взрыва, которые могли бы произвести дейтерий в количестве, близком к его наблюдаемому естественному содержанию. Дейтерий образуется в результате редкого распада кластера и случайного поглощения естественных нейтронов легким водородом, но это тривиальные источники. Считается, что внутри Солнца и других звезд мало дейтерия, так как при таких температурахреакции ядерного синтеза , в которых потребляется дейтерий, происходят намного быстрее, чем протон-протонная реакция, в результате которой образуется дейтерий. Однако дейтерий сохраняется во внешней атмосфере Солнца в примерно той же концентрации, что и на Юпитере, и это, вероятно, не изменилось с момента возникновения Солнечной системы. Естественное содержание дейтерия, по-видимому, очень похоже на долю водорода, где бы водород ни находился, если только не работают очевидные процессы, которые его концентрируют.
Существование дейтерия в низком, но постоянном содержании первичной фракции во всем водороде является еще одним аргументом в пользу теории Большого взрыва по сравнению с теорией устойчивого состояния Вселенной. Наблюдаемое соотношение водорода, гелия и дейтерия во Вселенной трудно объяснить, кроме как с помощью модели Большого взрыва. По оценкам, содержание дейтерия существенно не изменилось с момента его производства около 13,8 миллиарда лет назад. [12] Измерения галактического дейтерия в Млечном Пути с помощью ультрафиолетового спектрального анализа показывают соотношение целых 23 атомов дейтерия на миллион атомов водорода в невозмущенных газовых облаках, что всего на 15% ниже WMAP.По оценкам, изначальное соотношение около 27 атомов на миллион от Большого взрыва. Это было интерпретировано как означающее, что при звездообразовании в нашей галактике было разрушено меньше дейтерия, чем ожидалось, или, возможно, дейтерий был восполнен за счет большого поступления первичного водорода из-за пределов галактики. [13] В космосе в нескольких сотнях световых лет от Солнца содержание дейтерия составляет всего 15 атомов на миллион, но на это значение предположительно влияет дифференциальная адсорбция дейтерия на зернах углеродной пыли в межзвездном пространстве. [14]
Содержание дейтерия в атмосфере Юпитера было напрямую измерено космическим зондом «Галилео» как 26 атомов на миллион атомов водорода. Наблюдения ISO-SWS обнаружили 22 атома на миллион атомов водорода в Юпитере. [15], и считается, что это изобилие соответствует соотношению, близкому к изначальной солнечной системе. [5] Это примерно 17% земного отношения дейтерия к водороду, составляющего 156 атомов дейтерия на миллион атомов водорода.
Кометные тела, такие как комета Хейла-Боппа и комета Галлея , как было измерено, содержат относительно больше дейтерия (около 200 атомов D на миллион атомов водорода), отношения, которые обогащены по сравнению с предполагаемым соотношением протосолнечных туманностей, вероятно, из-за нагрева, и которые являются аналогичны отношениям, обнаруженным в морской воде Земли. Недавнее измерение количества дейтерия в 161 атоме D на миллион водорода в комете 103P / Хартли (бывший объект пояса Койпера ), соотношение почти точно такое же, как в океанах Земли, подчеркивает теорию о том, что поверхностные воды Земли могут в значительной степени образовываться из комет. [4] [5] Совсем недавно соотношение дейтерий-протий (D-H) 67P / Чурюмов-Герасименкопо измерениям Розетты примерно в три раза больше земной воды, и это очень высокий показатель. [6] Это вызвало новый интерес к предположениям о том, что вода на Земле может иметь частично астероидное происхождение.
Также наблюдалось, что концентрация дейтерия превышает среднюю солнечную концентрацию на других планетах земной группы, в частности на Марсе и Венере. [16]
Производство [ править ]
Дейтерий производят для промышленных, научных и военных целей, начиная с обычной воды, небольшую часть которой составляет тяжелая вода природного происхождения, а затем отделяя тяжелую воду с помощью сульфидного процесса Гирдлера , дистилляции или других методов.
Теоретически дейтерий для тяжелой воды можно было бы создать в ядерном реакторе, но отделение от обычной воды — самый дешевый процесс массового производства.
Ведущим поставщиком дейтерия в мире была компания Atomic Energy of Canada Limited до 1997 года, когда была остановлена последняя установка по производству тяжелой воды. Канада использует тяжелую воду в качестве замедлителя нейтронов для работы реактора CANDU .
Другой крупный производитель тяжелой воды — Индия. Все атомные электростанции Индии, кроме одной, представляют собой установки с тяжелой водой под давлением, в которых используется природный (т.е. необогащенный) уран. В Индии восемь заводов по производству тяжелой воды, семь из которых находятся в эксплуатации. Шесть установок, пять из которых находятся в эксплуатации, основаны на обмене D – H в газообразном аммиаке. Два других завода извлекают дейтерий из природной воды в процессе, в котором используется сероводород под высоким давлением.
В то время как Индия самодостаточна тяжелой водой для собственного использования, Индия теперь также экспортирует тяжелую воду реакторного качества.
Свойства [ править ]
Физические свойства [ править ]
По сравнению с водородом в его естественном составе на Земле, чистый дейтерий (D 2 ) имеет более высокую температуру плавления (18,72 ° C против 13,99 K), более высокую температуру кипения (23,64 K против 20,27 K), более высокую критическую температуру (38,3 K против 13,99 K). 32,94 К) и более высокое критическое давление (1,6496 МПа против 1,2858 МПа). [17]
Физические свойства соединений дейтерия могут проявлять значительные кинетические изотопные эффекты и другие физические и химические свойства, отличные от аналогов протия. D 2 O , к примеру, является более вязким , чем H 2 O . [18] Химически, существуют различия в энергии связи и длине для соединений тяжелых изотопов водорода по сравнению с протием, которые больше, чем изотопные различия в любом другом элементе. Связи с участием дейтерия и тритиянесколько сильнее, чем соответствующие связи в протии, и этих различий достаточно, чтобы вызвать существенные изменения в биологических реакциях. Фармацевтические фирмы заинтересованы в том, что дейтерий сложнее удалить из углерода, чем протий. [19]
Дейтерий может заменять протий в молекулах воды с образованием тяжелой воды (D 2 O), которая примерно на 10,6% плотнее, чем обычная вода (так что лед, сделанный из него, тонет в обычной воде). Тяжелая вода слабо токсична для эукариотических животных: 25% замещения воды в организме вызывают проблемы с делением клеток и бесплодие, а замещение 50% вызывает смерть от цитотоксического синдрома (недостаточность костного мозга и повреждение слизистой оболочки желудочно-кишечного тракта). Однако прокариотические организмы могут выжить и расти в чистой тяжелой воде, хотя и развиваются медленно. [20] Несмотря на эту токсичность, потребление тяжелой воды в нормальных условиях не представляет угрозы для здоровья.людям. Подсчитано, что человек весом 70 кг (154 фунта) может выпить 4,8 литра (1,3 галлона США) тяжелой воды без серьезных последствий. [21] Небольшие дозы тяжелой воды (несколько граммов для людей, содержащие количество дейтерия, сравнимое с тем, которое обычно присутствует в организме) обычно используются в качестве безвредных метаболических индикаторов для людей и животных.
Квантовые свойства [ править ]
Дейтрон имеет спин +1 (« триплетное состояние ») и, таким образом, является бозоном . Частота ЯМР дейтерия значительно отличается от обычного легкого водорода. Инфракрасная спектроскопия также легко дифференцирует многие дейтерированные соединения из-за большой разницы в частоте ИК-поглощения, наблюдаемой при колебании химической связи, содержащей дейтерий, по сравнению с легким водородом. Два стабильных изотопа водорода также можно различить с помощью масс-спектрометрии .
Нуклон триплетного дейтрона практически не связан при E B =2,23 МэВ , и ни одно из состояний с более высокой энергией не связано. Синглетный дейтрон представляет собой виртуальное состояние с отрицательной энергией связи~ 60 кэВ . Такой стабильной частицы нет, но эта виртуальная частица временно существует во время неупругого рассеяния нейтрона на протоне, что объясняет необычно большое сечение рассеяния нейтронов протоном. [22]
Ядерные свойства (дейтрон) [ править ]
Масса и радиус дейтрона [ править ]
Ядро дейтерия называется дейтроном . Имеет массу2,013 553 212 745 (40) u (чуть более1,875 ГэВ ). [23] [24]
Радиус заряда дейтрона2,127 99 (74) фм . [25]
Как и радиус протона , измерения с использованием мюонного дейтерия дают меньший результат:2.125 62 (78) фм . [26]
Спин и энергия [ править ]
Дейтерий — один из пяти стабильных нуклидов с нечетным числом протонов и нечетным числом нейтронов. (2
ЧАС
, 6
Ли
, 10
B
, 14
N
, 180 м
Та
; также долгоживущие радиоактивные нуклиды40
K
, 50
V
, 138
Ла
, 176
Лу
происходят естественно.) Большинство нечетно-нечетных ядер нестабильны по отношению к бета-распаду , потому что продукты распада четно-четные и, следовательно, более сильно связаны из-за эффектов ядерного спаривания . Дейтерий, однако, выигрывает от того, что его протон и нейтрон связаны со спином-1, что дает более сильное ядерное притяжение; соответствующее состояние со спином 1 не существует в двухнейтронной или двухпротонной системе из-за принципа исключения Паули, который требует, чтобы одна или другая идентичная частица с тем же спином имела другое квантовое число, такое как орбитальное угловой момент . Но орбитальный угловой момент любой частицы дает меньшее значение.энергия связи для системы, в первую очередь из-за увеличения расстояния между частицами в крутом градиенте ядерной силы. В обоих случаях это приводит к нестабильности ядра дипротона и динейтрона .
Протон и нейтрон, составляющие дейтерий, могут быть диссоциированы посредством взаимодействия нейтрального тока с нейтрино . Сечение этого взаимодействия сравнительно велико, и дейтерий был успешно использован в качестве мишени нейтрино в нейтринной обсерватории Садбери эксперименте.
Двухатомный дейтерий (D 2 ) имеет орто- и пара- ядерные спиновые изомеры, такие как двухатомный водород, но с различиями в количестве и населенности спиновых состояний и вращательных уровней , которые возникают из-за того, что дейтрон является бозоном с ядерным спином, равным единице. [27]
Изоспин-синглетное состояние дейтрона [ править ]
Из-за сходства массы и ядерных свойств между протоном и нейтроном их иногда рассматривают как два симметричных типа одного и того же объекта — нуклона . Хотя электрический заряд имеет только протон, им часто можно пренебречь из-за слабости электромагнитного взаимодействия по сравнению с сильным ядерным взаимодействием . Симметрия, связывающая протон и нейтрон, известна как изоспин и обозначается I (или иногда T ).
Изоспин — это симметрия SU (2) , как и обычный спин , поэтому он полностью аналогичен ей. Протон и нейтрон, каждый из которых имеет изо- спин — 1 / 2 , образует изоспиновой дублет (аналогичный на спин дублет ), с «вниз» состоянием (↓) будучи нейтроном и «вверх» состояние (↑) существо протон. [ необходима цитата ] Пара нуклонов может находиться либо в антисимметричном состоянии изоспина, называемом синглетом , либо в симметричном состоянии, называемом триплетом . Что касается состояния «вниз» и «вверх», синглет
, что также можно записать:
Это ядро с одним протоном и одним нейтроном, то есть ядро дейтерия. Тройка
и, таким образом, состоит из трех типов ядер, которые считаются симметричными: ядро дейтерия (фактически, его высоковозбужденное состояние ), ядро с двумя протонами и ядро с двумя нейтронами. Эти состояния нестабильны.
Приближенная волновая функция дейтрона [ править ]
Волновая функция дейтрона должна быть антисимметричной, если используется изоспиновое представление (поскольку протон и нейтрон не являются идентичными частицами, волновая функция в целом не обязательно должна быть антисимметричной). Помимо изоспина, два нуклона также имеют спиновые и пространственные распределения своей волновой функции. Последний является симметричным, если дейтрон является симметричным относительно четности (т.е. имеет «четную» или «положительную» четность), и антисимметричным, если дейтрон антисимметричен относительно четности (т.е. имеет «нечетную» или «отрицательную» четность). Четность полностью определяется полным орбитальным угловым моментом двух нуклонов: если он четный, то четность четная (положительная), а если она нечетная, то четность нечетная (отрицательная).
Дейтрон, будучи изоспиновым синглетом, антисимметричен по отношению к обмену нуклонами из-за изоспина и, следовательно, должен быть симметричным по отношению к двойному обмену их спина и местоположения. Следовательно, он может находиться в любом из следующих двух разных состояний:
- Симметричный спин и симметричный относительно четности. В этом случае обмен двумя нуклонами умножит волновую функцию дейтерия на (-1) из-за изоспинового обмена, (+1) из-за спинового обмена и (+1) из-за четности (обмен местоположения), в общей сложности (-1 ) по мере необходимости для антисимметрии.
- Антисимметричный спин и антисимметричный по четности. В этом случае обмен двумя нуклонами умножит волновую функцию дейтерия на (-1) из-за изоспинового обмена, (-1) из-за спинового обмена и (-1) из-за четности (обмен местоположения), снова в сумме (- 1) для антисимметрии.
В первом случае дейтрон представляет собой спиновый триплет, так что его полный спин s равен 1. Он также имеет четность и, следовательно, орбитальный угловой момент l ; Чем меньше его орбитальный угловой момент, тем меньше его энергия. Следовательно, самое низкое возможное энергетическое состояние имеет s = 1 , l = 0 .
Во втором случае дейтрон является спиновым синглетом, так что его полный спин s равен 0. Он также имеет нечетную четность и, следовательно, нечетный орбитальный угловой момент l . Следовательно, самое низкое возможное энергетическое состояние имеет s = 0 , l = 1 .
Поскольку s = 1 дает более сильное ядерное притяжение, основное состояние дейтерия находится в состоянии s = 1 , l = 0 .
Те же соображения приводят к возможным состояниям изоспинового триплета, имеющего s = 0 , l = четное или s = 1 , l = нечетное . Таким образом, состояние с наименьшей энергией имеет s = 1 , l = 1 , выше, чем у изоспинового синглета.
Только что приведенный анализ на самом деле является лишь приблизительным, как потому, что изоспин не является точной симметрией, так и, что более важно, потому что сильное ядерное взаимодействие между двумя нуклонами связано с угловым моментом в спин-орбитальном взаимодействии, которое смешивает различные s- и l- состояния. То есть s и l не являются постоянными во времени (они не коммутируют с гамильтонианом ), и со временем такое состояние, как s = 1 , l = 0, может стать состоянием s = 1 , l = 2.. Четность по-прежнему постоянна во времени, поэтому они не смешиваются с нечетными l состояниями (такими как s = 0 , l = 1 ). Следовательно, квантовое состояние дейтерия является суперпозицией (линейной комбинацией) состояния s = 1 , l = 0 и состояния s = 1 , l = 2 , даже если первый компонент намного больше. Поскольку полный угловой момент j также является хорошим квантовым числом (он постоянен во времени), оба компонента должны иметь одинаковое j , и, следовательно,j = 1 . Это полный спин ядра дейтерия.
Итак, ядро дейтерия антисимметрично по изоспину и имеет спин 1 и четность (+1). Относительный угловой момент его нуклонов l точно не определен, а дейтрон представляет собой суперпозицию в основном l = 0 с некоторым l = 2 .
Магнитные и электрические мультиполи [ править ]
Чтобы теоретически найти дипольный магнитный момент дейтерия μ, используется формула для ядерного магнитного момента
с участием
g (l) и g (s) — g-факторы нуклонов.
Поскольку протон и нейтрон имеют разные значения для g (l) и g (s) , необходимо разделить их вклады. Каждый получает половину орбитального углового момента дейтерия.

где нижние индексы p и n обозначают протон и нейтрон, а g (l) n = 0 .
Используя те же тождества, что и здесь, и значение g (l) p = 1 , мы приходим к следующему результату в единицах ядерного магнетона μ N
Для состояния s = 1 , l = 0 ( j = 1 ) получаем
Для состояния s = 1 , l = 2 ( j = 1 ) получаем
Измеренное значение магнитного дипольного момента дейтерия составляет0,857 М Н , что 97,5% от0,879 μ N значение , полученное путем простого добавления моментов протона и нейтрона. Это говорит о том, что состояние дейтерия действительно в хорошем приближении s = 1 , l = 0 состояние, которое происходит с обоими нуклонами, вращающимися в одном направлении, но их магнитные моменты вычитаются из-за отрицательного момента нейтрона.
Но немного меньшее экспериментальное число, чем то, которое получается в результате простого сложения протонного и (отрицательного) нейтронного моментов, показывает, что дейтерий на самом деле представляет собой линейную комбинацию в основном состояния s = 1 , l = 0 с небольшой примесью s = 1 , l = 2 состояние.
Электрический диполь равен нулю , как обычно .
Измеренный электрический квадруполь дейтерия равен0,2859 э · фм 2 . Хотя порядок величины является разумным, поскольку радиус дейтерия составляет порядка 1 фемтометра (см. Ниже), а его электрический заряд равен e, вышеуказанной модели недостаточно для ее расчета. Более конкретно, электрический квадруполь не получает вклада от состояния l = 0 (которое является доминирующим) и действительно получает вклад от члена, смешивающего состояния l = 0 и l = 2, потому что оператор электрического квадруполя делает не коммутируют с угловым моментом .
Последний вклад является доминирующим в отсутствие чистого l = 0 вклада, но его нельзя вычислить, не зная точной пространственной формы волновой функции нуклонов внутри дейтерия.
Высшие магнитные и электрические мультипольные моменты не могут быть рассчитаны с помощью вышеупомянутой модели по аналогичным причинам.
Приложения [ править ]
Дейтерий имеет ряд коммерческих и научных применений. Это включает:
Ядерные реакторы [ править ]
Ионизированный дейтерий в фузорном реакторе излучает характерное розовато-красное свечение
Дейтерий используется в реакторах деления с замедлителем тяжелой воды , обычно в виде жидкого D 2 O, для замедления нейтронов без высокого поглощения нейтронов, как у обычного водорода. [28] Это обычное коммерческое использование больших количеств дейтерия.
В исследовательских реакторах жидкий D 2 используется в холодных источниках для смягчения нейтронов до очень низких энергий и длин волн, подходящих для экспериментов по рассеянию .
Экспериментально дейтерий является наиболее распространенным нуклидом, используемым в конструкциях термоядерных реакторов, особенно в сочетании с тритием , из-за большой скорости реакции (или ядерного поперечного сечения ) и высокого выхода энергии D – T реакции. Есть еще более доходный D–3
Он
реакция синтеза, хотя точка безубыточности D–3
Он
выше, чем у большинства других реакций синтеза; вместе с нехваткой3
Он
, это делает его неприемлемым в качестве практического источника энергии до тех пор, пока, по крайней мере, реакции синтеза D – T и D – D не будут выполнены в промышленном масштабе. Коммерческий ядерный синтез еще не реализован.
ЯМР-спектроскопия [ править ]

Дейтерий чаще всего используется в спектроскопии ядерного магнитного резонанса водорода ( протонный ЯМР ) следующим образом. ЯМР обычно требует, чтобы интересующие соединения анализировались как растворенные в растворе. Из-за ядерных спиновых свойств дейтерия, которые отличаются от легкого водорода, обычно присутствующего в органических молекулах, спектры ЯМР водорода / протия сильно отличаются от спектров дейтерия, и на практике дейтерий не «виден» прибором ЯМР, настроенным на легкий водород. . Дейтерированные растворители (включая тяжелую воду, а также такие соединения, как дейтерированный хлороформ, CDCl 3) поэтому обычно используются в ЯМР-спектроскопии, чтобы можно было измерять только спектры легкого водорода интересующего соединения без интерференции сигнала растворителя.
Спектроскопия ядерного магнитного резонанса также может быть использована для получения информации об окружении дейтрона в образцах, меченных изотопами ( ЯМР дейтерия ). Например, гибкость хвоста, представляющего собой длинную углеводородную цепь, в молекулах липидов, меченных дейтерием, можно количественно оценить с помощью твердотельного дейтериевого ЯМР. [29]
Спектры ЯМР дейтерия особенно информативны в твердом состоянии из-за его относительно небольшого квадрупольного момента по сравнению с более крупными квадрупольными ядрами, такими как, например, хлор-35.
Отслеживание [ править ]
В химии , биохимии и науках об окружающей среде дейтерий используется в качестве нерадиоактивного стабильного изотопного индикатора , например, в тесте воды с двойной меткой . В химических реакциях и метаболических путях дейтерий ведет себя подобно обычному водороду (с некоторыми химическими отличиями, как уже отмечалось). Его легче всего отличить от обычного водорода по его массе с помощью масс-спектрометрии или инфракрасной спектрометрии . Дейтерий можно обнаружить с помощью фемтосекундного инфракрасного излучения.спектроскопия, так как разница масс резко влияет на частоту молекулярных колебаний; Колебания связи дейтерий-углерод обнаруживаются в спектральных областях, свободных от других сигналов.
Измерения небольших вариаций естественного содержания дейтерия, а также стабильных изотопов тяжелого кислорода 17 O и 18 O имеют важное значение в гидрологии , чтобы проследить географическое происхождение вод Земли. Тяжелые изотопы водорода и кислорода в дождевой воде (так называемая метеорная вода ) обогащаются в зависимости от температуры окружающей среды в регионе, в котором выпадают осадки (и, таким образом, обогащение связано со средней широтой). Относительное обогащение тяжелыми изотопами в дождевой воде (по отношению к средней воде океана), если график зависимости от температуры предсказуемо падает вдоль линии, называемой глобальной линией метеорной воды.(GMWL). Этот график позволяет идентифицировать образцы воды, образовавшейся в результате атмосферных осадков, а также общую информацию о климате, в котором они возникли. Процессы испарения и другие процессы в водоемах, а также процессы в грунтовых водах также по-разному изменяют соотношения тяжелых изотопов водорода и кислорода в пресных и соленых водах характерными и часто регионально различимыми способами. [30] Отношение концентраций 2 H к 1 H обычно обозначается дельтой как δ 2 H, и географические закономерности этих значений наносятся на карты, называемые изоскопами. Стабильные изотопы входят в состав растений и животных, и анализ соотношений у перелетных птиц или насекомых может помочь предложить приблизительное руководство по их происхождению.[31] [32]
Свойства контраста [ править ]
Методы рассеяния нейтронов особенно выигрывают от наличия дейтерированных образцов: сечения H и D очень различны и различаются по знаку, что позволяет варьировать контраст в таких экспериментах. Кроме того, неприятной проблемой обычного водорода является его большое некогерентное нейтронное сечение, которое равно нулю для D. Таким образом, замещение атомов водорода атомами дейтерия снижает шум рассеяния.
Водород — важный и главный компонент во всех материалах органической химии и наук о жизни, но он почти не взаимодействует с рентгеновскими лучами. Поскольку водород (и дейтерий) сильно взаимодействуют с нейтронами, методы рассеяния нейтронов вместе с современной установкой дейтерирования [33] заполняют нишу во многих исследованиях макромолекул в биологии и многих других областях.
Ядерное оружие [ править ]
Это обсуждается ниже. Примечательно, что, хотя большинство звезд, включая Солнце, генерируют энергию на протяжении большей части своей жизни, превращая водород в более тяжелые элементы, такой синтез легкого водорода (протия) никогда не был успешным в условиях, достижимых на Земле. Таким образом, весь искусственный синтез, включая синтез водорода, который происходит в так называемых водородных бомбах, требует тяжелого водорода (трития или дейтерия, либо того и другого) для того, чтобы этот процесс работал.
Наркотики [ править ]
Дейтерированное лекарственное средство — это лекарственный препарат с небольшими молекулами, в котором один или несколько атомов водорода, содержащихся в молекуле лекарственного средства, заменены дейтерием. Из-за кинетического изотопного эффекта дейтерийсодержащие препараты могут иметь значительно более низкие скорости метаболизма и, следовательно, более длительный период полураспада . [34] [35] [36] В 2017 году дьютетрабеназин стал первым дейтерированным препаратом, получившим одобрение FDA. [37]
Усиленные незаменимые питательные вещества [ править ]
Дейтерий могут быть использованы для усиления конкретных окисления-уязвимы СН — связей в пределах существенных или условно необходимых питательных веществ , [38] , такие как определенные аминокислоты , или полиненасыщенных жирных кислот (ПНЖК), что делает их более устойчивыми к окислительному повреждению. Дейтерированные полиненасыщенные жирные кислоты , такие как линолевая кислота , замедляют цепную реакцию перекисного окисления липидов, которая повреждает живые клетки. [39] [40] Дейтерированный этиловый эфир линолевой кислоты ( RT001 ), разработанный Retrotope, проходит испытание в отношении сострадательного использования винфантильной нейроаксональной дистрофии и успешно завершил исследование фазы I / II атаксии Фридрейха . [41] [37]
Термостабилизация [ править ]
Живые вакцины, такие как пероральная вакцина против полиовируса , могут быть стабилизированы дейтерием, отдельно или в комбинации с другими стабилизаторами, такими как MgCl 2 . [42]
Замедление циркадных колебаний [ править ]
Было показано, что дейтерий удлиняет период колебаний циркадных часов при введении крысам, хомякам и динофлагеллятам Gonyaulax . [43] [44] [45] [46] У крыс хроническое потребление 25% D 2 O нарушает циркадную ритмику, удлиняя циркадный период супрахиазматических ядерно-зависимых ритмов в гипоталамусе мозга. [47] Эксперименты на хомяках также подтверждают теорию о том, что дейтерий действует непосредственно на супрахиазматическое ядро, удлиняя свободный циркадный период. [48]
История [ править ]
Подозрение на изотопы более легких элементов [ править ]
Существование нерадиоактивных изотопов более легких элементов подозревалось в исследованиях неона еще в 1913 году и доказано масс-спектрометрией легких элементов в 1920 году. Преобладающая теория в то время заключалась в том, что изотопы элемента различаются наличием дополнительных протонов. в ядре сопровождается равным числом ядерных электронов . Согласно этой теории, ядро дейтерия с массой два и зарядом один будет содержать два протона и один ядерный электрон. Однако ожидалось, что элемент водород с измеренной средней атомной массой очень близок к1 u , известная масса протона, всегда имеет ядро, состоящее из одного протона (известной частицы), и не может содержать второй протон. Таким образом, считалось, что водород не имеет тяжелых изотопов.
Обнаружен дейтерий [ править ]

Впервые он был обнаружен спектроскопически в конце 1931 года Гарольдом Юри , химиком из Колумбийского университета . Коллаборатор Урея, Фердинанд Брикведд , дистиллированная пять литров из криогенно полученного жидкого водорода в1 мл жидкости, используя лабораторию низкотемпературной физики, которая была недавно создана при Национальном бюро стандартов в Вашингтоне, округ Колумбия (ныне Национальный институт стандартов и технологий ). Ранее этот метод использовался для выделения тяжелых изотопов неона. Метод криогенного испарения концентрировал фракцию изотопа водорода с массой 2 до такой степени, что его спектроскопическая идентификация была однозначной. [49] [50]
Название изотопа и Нобелевской премии [ править ]
Юри создал названия протий , дейтерий и тритий в статье, опубликованной в 1934 году. Название частично основано на совете Г.Н. Льюиса , предложившего название «дейтерий». Название происходит от греческого deuteros («второй»), а ядро следует называть «дейтрон» или «дейтон». Изотопам и новым элементам традиционно давали имя, которое решил их первооткрыватель. Некоторые британские ученые, такие как Эрнест Резерфорд , хотели, чтобы изотоп назывался «диплоген» от греческого « диплоос» («двойной»), а ядро - «дипломат». [3] [51]
Количество, предполагаемое для нормального содержания этого тяжелого изотопа водорода, было настолько маленьким (всего около 1 атома на 6400 атомов водорода в океанской воде (156 дейтерия на миллион водородов)), что оно не оказало заметного влияния на предыдущие измерения (средней) атомной массы водорода. . Это объясняло, почему раньше об этом не подозревали. Юри смог сконцентрировать воду, чтобы показать частичное обогащение дейтерием. Льюис подготовил первые образцы чистой тяжелой воды в 1933 году. Открытие дейтерия, предшествовавшее открытию нейтрона в 1932 году, было экспериментальным потрясением для теории, но когда было сообщено о нейтроне, что сделало существование дейтерия более объяснимым, дейтерий победил. Юри, лауреат Нобелевской премии по химиив 1934 году. Льюис был озлоблен тем, что его обошли стороной за это признание, данное его бывшему ученику. [3]
Эксперименты с «тяжелой водой» во Второй мировой войне [ править ]
Незадолго до войны Ханс фон Халбан и Лью Коварски переместили свои исследования замедления нейтронов из Франции в Великобританию, переправив все мировые запасы тяжелой воды (произведенной в Норвегии) в 26 стальных бочках. [52] [53]
Во время Второй мировой войны , нацистская Германия была , как известно, проводят эксперименты с использованием тяжелой воды в качестве замедлителя для ядерного реактора дизайна. Такие эксперименты вызвали беспокойство, потому что они могли позволить им производить плутоний для атомной бомбы . В конечном итоге это привело к операции союзников под названием « Норвежский саботаж тяжелой воды », целью которой было уничтожение завода по производству / обогащению дейтерия Веморк в Норвегии. В то время это считалось важным для потенциального прогресса войны.
После окончания Второй мировой войны союзники обнаружили, что Германия не вкладывает в эту программу столько серьезных усилий, как предполагалось ранее. Они не смогли выдержать цепную реакцию. Немцы построили только небольшой, частично построенный экспериментальный реактор (который был спрятан). К концу войны у немцев не было даже пятой части тяжелой воды, необходимой для работы реактора, [ необходимы разъяснения ], частично из-за норвежской диверсионной операции с тяжелой водой. Однако, даже если бы немцам удалось запустить реактор (как США сделали с графитовым реактором в конце 1942 г.), до разработки атомной бомбы оставалось бы по крайней мере несколько лет.. Процесс проектирования, даже с максимальными усилиями и финансированием, потребовал около двух с половиной лет (от первого критического реактора до бомбы), например, как в США, так и в СССР .
В термоядерном оружии [ править ]

Корпус устройства «Колбаса» бомбы Ivy Mike H , прикрепленной к контрольно-измерительным приборам и криогенному оборудованию. Бомба высотой 20 футов содержала криогенную колбу Дьюара, вмещавшую 160 кг жидкого дейтерия.
62-тонное устройство Ivy Mike, созданное Соединенными Штатами и взорвавшееся 1 ноября 1952 года, стало первой полностью успешной « водородной бомбой » (термоядерной бомбой). В этом контексте это была первая бомба, в которой большая часть высвободившейся энергии пришла на стадии ядерной реакции, которые следовали за первичной стадией ядерного деления атомной бомбы . Бомба Айви Майка была похожим на фабрику зданием, а не оружием, которое можно было доставить. В его центре была очень большая цилиндрическая изолированная вакуумная колба или криостат , в которой хранился криогенный жидкий дейтерий в объеме около 1000 литров.(Массой 160 килограммов, если бы этот объем был заполнен полностью). Затем обычная атомная бомба («первичная») на одном конце бомбы использовалась для создания условий экстремальной температуры и давления, необходимых для запуска термоядерной реакции .
В течение нескольких лет были разработаны так называемые «сухие» водородные бомбы, для которых не требовался криогенный водород. Обнародованная информация предполагает, что все термоядерное оружие, созданное с тех пор, содержит химические соединения дейтерия и лития на вторичных стадиях. Материал, который содержит дейтерий, в основном представляет собой дейтерид лития , причем литий состоит из изотопа лития-6 . Когда литий-6 бомбардируется быстрыми нейтронами атомной бомбы, образуется тритий (водород-3), а затем дейтерий и тритий быстро вступают в термоядерный синтез , высвобождая много энергии, гелий-4 и даже больше свободных нейтронов. .
Современные исследования [ править ]
В августе 2018 года ученые объявили о превращении газообразного дейтерия в жидкую металлическую форму . Это может помочь исследователям лучше понять гигантские газовые планеты , такие как Юпитер, Сатурн и связанные с ними экзопланеты , поскольку считается, что такие планеты содержат большое количество жидкого металлического водорода, который может быть ответственным за наблюдаемые ими мощные магнитные поля . [54] [55]
Данные для элементарного дейтерия [ править ]
Формула: D 2 или2
1ЧАС
2
- Плотность: 0,180 кг / м 3 на СТП (0 ° C ,101,325 кПа ).
- Атомный вес: 2.014 101 7926 ед .
- Среднее содержание в океанской воде (по VSMOW ) 155,76 ± 0,1 частей на миллион (соотношение 1 часть на примерно 6420 частей), то есть примерно0,015% атомов в образце (по количеству, а не по весу)
Данные примерно на 18 К для D 2 ( тройная точка ):
- Плотность:
- Жидкость: 162,4 кг / м 3
- Газ: 0,452 кг / м 3
- Вязкость: 12,6 мкПа · с при300 К (газовая фаза)
- Удельная теплоемкость при постоянном давлении c p :
- Твердый: 2950 Дж / (кг · К)
- Газ: 5200 Дж / (кг · К)
Антидейтерий [ править ]
Антидейтон является антиматерия аналога ядра дейтерия, состоящий из антипротона и антинейтрона . Антидейтрон был впервые получен в 1965 году на протонном синхротроне в ЦЕРНе [56] и в синхротроне с переменным градиентом в Брукхейвенской национальной лаборатории . [57] Полный атом с позитроном, вращающимся вокруг ядра, будет называться антидейтерий , но по состоянию на 2019 год антидейтерий еще не был создан. Предлагаемый символ антидейтерия:
D
, то есть D с чертой сверху. [58]
См. Также [ править ]
- Изотопы водорода
- Термоядерная реакция
- Токамак
- Тритий
- Тяжелая вода
Ссылки [ править ]
- ^ Hagemann, R; Nief, G; Рот, Э (1970). «Абсолютная изотопная шкала для дейтериевого анализа природных вод. Абсолютное соотношение D / H для SMOW 1». Теллус . 22 (6): 712-715. DOI : 10.1111 / j.2153-3490.1970.tb00540.x .
- ^ Ван, М .; Audi, G .; Кондев Ф.Г .; Хуанг, WJ; Naimi, S .; Сюй, X. (2017). «Оценка атомной массы AME2016 (II). Таблицы, графики и ссылки» (PDF) . Китайская физика C . 41 (3): 030003-1–030003-442. DOI : 10.1088 / 1674-1137 / 41/3/030003 .
- ^ a b c О’Лири D (февраль 2012 г.). «Дело дейтерия». Химия природы . 4 (3): 236. Bibcode : 2012NatCh … 4..236O . DOI : 10.1038 / nchem.1273 . PMID 22354440 .
- ^ а б Хартог П., Лис Д.К., Бокеле-Морван Д., де Валь-Борро М., Бивер Н., Кюпперс М. и др. (Октябрь 2011 г.). «Океаноподобная вода в комете семейства Юпитера 103P / Hartley 2». Природа . 478 (7368): 218–20. Bibcode : 2011Natur.478..218H . DOI : 10,1038 / природа10519 . PMID 21976024 . S2CID 3139621 .
- ^ a b c Hersant F, Gautier D, Hure J (2001). «Двумерная модель первичной туманности, ограниченная измерениями D / H в Солнечной системе: последствия для образования гигантских планет» . Астрофизический журнал . 554 (1): 391–407. Bibcode : 2001ApJ … 554..391H . DOI : 10.1086 / 321355 .
см. рис. 7. для обзора отношений D / H в различных астрономических объектах.
- ^ a b Альтвегг К., Балсигер Х., Бар-Нун А, Бертелье Дж. Дж., Билер А., Бохслер П. и др. (Январь 2015 г.). «Кометаология. 67P / Чурюмов-Герасименко, семейная комета Юпитера с высоким отношением D / H» (PDF) . Наука . 347 (6220): 1261952. Bibcode : 2015Sci … 347A.387A . DOI : 10.1126 / science.1261952 . PMID 25501976 . S2CID 206563296 .
- ^ «§ IR-3.3.2 Предварительные рекомендации» . Номенклатура неорганической химии . Отдел химической номенклатуры и структурного представления, ИЮПАК . Архивировано из оригинального 27 -го октября 2006 года . Проверено 3 октября 2007 года .
- ^ Hébrard G, D Péquignot, Видал-Маджар А, Уолш JR, Ferlet R (7 февраля 2000 года). «Обнаружение дейтерийных бальмеровских линий в туманности Ориона». Астрономия и астрофизика . 354 : L79. arXiv : astro-ph / 0002141 . Бибкод : 2000A & A … 354L..79H .
- ^ Спектр поглощения воды . lsbu.ac.uk
- ^ Вайс А. «Равновесие и изменение: физика нуклеосинтеза Большого взрыва» . Эйнштейн Онлайн . Проверено 24 февраля 2007 года .
- ^ Комиссия ИЮПАК по номенклатуре неорганической химии (2001). «Названия атомов мюония и водорода и их ионов» (PDF) . Чистая и прикладная химия . 73 (2): 377–380. DOI : 10,1351 / pac200173020377 . S2CID 97138983 .
- ^ «Космические детективы» . Европейское космическое агентство (ЕКА). 2 апреля 2013 . Проверено 15 апреля 2013 года .
- ^ NASA FUSE Satellite Решает Случай Отсутствующие дейтерий . НАСА
- ^ график дейтерия с расстоянием в нашем галактическом окружении. Архивировано 5 декабря 2013 года на Wayback Machine. См. также Linsky JL, Draine BT, Moos HW, Jenkins EB, Wood BE, Oliveira C и др. (2006). «Каково полное содержание дейтерия в местном галактическом диске?». Астрофизический журнал . 647 (2): 1106–1124. arXiv : astro-ph / 0608308 . Bibcode : 2006ApJ … 647.1106L . DOI : 10.1086 / 505556 . S2CID 14461382 .
- ^ Lellouch Е, Bézard В, Фуше Т, Feuchtgruber Н, Encrenaz Т, Т де Graauw (2001). «Содержание дейтерия в Юпитере и Сатурне по наблюдениям ISO-SWS» (PDF) . Астрономия и астрофизика . 670 (2): 610–622. Бибкод : 2001A & A … 370..610L . DOI : 10.1051 / 0004-6361: 20010259 .
- ^ Хантен, Дональд М. (1993). «Атмосферная эволюция планет земной группы» . Наука . 259 (5097): 915–920. Bibcode : 1993Sci … 259..915H . DOI : 10.1126 / science.259.5097.915 . ISSN 0036-8075 . JSTOR 2880608 . S2CID 178360068 .
- ^ «Дейтерий | H2 — PubChem» .
- ^ Лида, DR, изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ↑ Halford B (4 июля 2016 г.). «Переключатель дейтерия». Новости химии и машиностроения . Американское химическое общество . С. 32–36.
- Перейти ↑ Kushner DJ, Baker A, Dunstall TG (февраль 1999 г.). «Фармакологические применения и перспективы тяжелой воды и дейтерированных соединений». Канадский журнал физиологии и фармакологии . 77 (2): 79–88. DOI : 10,1139 / cjpp-77-2-79 . PMID 10535697 .
- ^ Вертес, Аттила, изд. (2003). «Физиологическое действие тяжелой воды» . Элементы и изотопы: образование, превращение, распределение . Дордрехт: Клувер. С. 111–112. ISBN 978-1-4020-1314-0.
- ^ Нейтрон-протонное рассеяние . (PDF). mit.edu. Проверено 23 ноября 2011.
- ^ масса дейтрона в u . Physics.nist.gov. Проверено 18 сентября 2020.
- ^ Эквивалент энергии массы дейтрона в МэВ . Physics.nist.gov. Проверено 18 сентября 2020.
- ^ среднеквадратичный зарядовый радиус дейтрона . Physics.nist.gov. Проверено 18 сентября 2020.
- ^ Поль Р., Нез Ф, Фернандес Л. М., Амаро Ф. Д., Бирабен Ф., Кардосо Дж. М. и др. (Сотрудничество CREMA) (август 2016 г.). «Лазерная спектроскопия мюонного дейтерия». Наука . 353 (6300): 669–73. Bibcode : 2016Sci … 353..669P . DOI : 10.1126 / science.aaf2468 . ЛВП : 10316/80061 . PMID 27516595 . S2CID 206647315 .
- ^ Hollas JM (1996). Современная спектроскопия (3-е изд.). Джон Уайли и сыновья. п. 115. ISBN 0-471-96523-5.
- ^ См. Нейтронное сечение # Типичные сечения
- ^ Seelig J (октябрь 1971). «О гибкости углеводородных цепей в липидных бислоях». Журнал Американского химического общества . 93 (20): 5017–22. DOI : 10.1021 / ja00749a006 . PMID 4332660 .
- ^ «Кислород — изотопы и гидрология» . САХРА. Архивировано из оригинального 2 -го января 2007 года . Проверено 10 сентября 2007 года .
- Перейти ↑ West JB (2009). Изотопы: понимание движения, закономерностей и процессов на Земле с помощью изотопного картирования . Springer.
- ^ Хобсон К., Ван Wilgenburg SL, Вассенаарское LI, Larson K (2012). «Связывание изотопов водорода (δ2H) в перьях и осадках: источники дисперсии и последствия для отнесения к изоскопам» . PLOS ONE . 7 (4): e35137. Bibcode : 2012PLoSO … 735137H . DOI : 10.1371 / journal.pone.0035137 . PMC 3324428 . PMID 22509393 .
- ^ «NMI3 — Дейтерирование» . NMI3 . Проверено 23 января 2012 года .
- ↑ Сандерсон К. (март 2009 г.). «Большой интерес к тяжелым наркотикам». Природа . 458 (7236): 269. DOI : 10.1038 / 458269a . PMID 19295573 . S2CID 4343676 .
- Перейти ↑ Katsnelson A (июнь 2013 г.). «Тяжелые наркотики вызывают большой интерес со стороны фармацевтических спонсоров». Природная медицина . 19 (6): 656. DOI : 10.1038 / nm0613-656 . PMID 23744136 . S2CID 29789127 .
- ↑ Gant TG (май 2014 г.). «Использование дейтерия в открытии лекарств: оставление этикетки в лекарстве». Журнал медицинской химии . 57 (9): 3595–611. DOI : 10.1021 / jm4007998 . PMID 24294889 .
- ^ a b Шмидт C (июнь 2017 г.). «Первый дейтерированный препарат одобрен». Природа Биотехнологии . 35 (6): 493–494. DOI : 10.1038 / nbt0617-493 . PMID 28591114 . S2CID 205269152 .
- ↑ Демидов В.В. (сентябрь 2007 г.). «Тяжелые изотопы для предотвращения старения?». Тенденции в биотехнологии . 25 (9): 371–5. DOI : 10.1016 / j.tibtech.2007.07.007 . PMID 17681625 .
- ^ Холливелл, Барри; Гаттеридж, Джон MC (2015). Свободная радикальная биология и медицина (5-е изд.). Оксфорд: Clarendon Press. ISBN 9780198717485 .
- ^ Hill S, Lamberson CR, Xu L, To R, Tsui HS, Shmanai VV, et al. (Август 2012 г.). «Небольшие количества усиленных изотопами полиненасыщенных жирных кислот подавляют автоокисление липидов» . Свободная радикальная биология и медицина . 53 (4): 893–906. DOI : 10.1016 / j.freeradbiomed.2012.06.004 . PMC 3437768 . PMID 22705367 .
- ^ «Рандомизированное, двойное слепое, контролируемое исследование для оценки безопасности, переносимости и фармакокинетики RT001 у пациентов с атаксией Фридрейха» . 24 ноября 2020.
- ^ У Р, Георгеску М.М., Delpeyroux Ж, Гиллот S, J Balanant, Симпсон К, Р Crainic (август 1995 г.). «Термостабилизация живых вирусных вакцин тяжелой водой (D2O)». Вакцина . 13 (12): 1058–63. DOI : 10.1016 / 0264-410X (95) 00068-C . PMID 7491812 .
- ^ Lesauter Дж, серебро Р (сентябрь 1993). «Тяжелая вода удлиняет период свободных ритмов у пораженных хомяков с трансплантатами SCN». Физиология и поведение . 54 (3): 599–604. DOI : 10.1016 / 0031-9384 (93) 90255-E . ISSN 0031-9384 . PMID 8415956 . S2CID 32466816 .
- ↑ McDaniel M, Sulzman FM, Hastings JW (ноябрь 1974 г.). «Тяжелая вода замедляет часы Гоньяулакса: проверка гипотезы о том, что D2O влияет на циркадные колебания, уменьшая видимую температуру» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (11): 4389–91. Bibcode : 1974PNAS … 71.4389M . DOI : 10.1073 / pnas.71.11.4389 . PMC 433889 . PMID 4530989 .
- ^ Петерсен CC, Mistlberger RE (август 2017). «Интервал времени сохраняется, несмотря на циркадную десинхронию у крыс: исследования постоянного света и тяжелой воды» . Журнал биологических ритмов . 32 (4): 295–308. DOI : 10.1177 / 0748730417716231 . PMID 28651478 . S2CID 4633617 .
- ^ Рихтер CP (март 1977). «Тяжелая вода как инструмент для изучения сил, контролирующих продолжительность периода 24-часовых часов хомяка» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (3): 1295–9. Bibcode : 1977PNAS … 74.1295R . DOI : 10.1073 / pnas.74.3.1295 . PMC 430671 . PMID 265574 .
- ^ Петерсен CC, Mistlberger RE (август 2017). «Интервал времени сохраняется, несмотря на циркадную десинхронию у крыс: исследования постоянного света и тяжелой воды» . Журнал биологических ритмов . 32 (4): 295–308. DOI : 10.1177 / 0748730417716231 . PMID 28651478 . S2CID 4633617 .
- ^ Lesauter Дж, серебро Р (сентябрь 1993). «Тяжелая вода удлиняет период свободных ритмов у пораженных хомяков с трансплантатами SCN». Физиология и поведение . 54 (3): 599–604. DOI : 10.1016 / 0031-9384 (93) 90255-E . PMID 8415956 . S2CID 32466816 .
- ^ Брикведде FG (1982). «Гарольд Юри и открытие дейтерия». Физика сегодня . 35 (9): 34. Bibcode : 1982PhT …. 35i..34B . DOI : 10.1063 / 1.2915259 .
- ^ Урей Н, Брикведде F, G Мерфи (1932). «Изотоп водорода с массой 2» . Физический обзор . 39 (1): 164–165. Полномочный код : 1932PhRv … 39..164U . DOI : 10.1103 / PhysRev.39.164 .
- ^ «Наука: Дейтерий против Диплогена» . Время . 19 февраля 1934. Архивировано из оригинала 15 сентября 2009 года.
- ^ Sherriff L (1 июня 2007). «Королевское общество раскрывает сверхсекретные ядерные исследования» . Регистр . Ситуация Publishing Ltd . Проверено 3 июня 2007 года .
- ^ «Битва за тяжелую воду Героические подвиги трех физиков» . Бюллетень ЦЕРН . Европейская организация ядерных исследований . 25 марта 2002 . Дата обращения 2 ноября 2015 .
- ↑ Chang K (16 августа 2018). «Урегулирование споров о водороде с помощью 168 гигантских лазеров» . Нью-Йорк Таймс . Проверено 18 августа 2018 .
- ↑ «Под давлением водород отражает внутренности гигантских планет» . Научный институт Карнеги. 15 августа 2018 . Проверено 19 августа 2018 .
- ^ Massam Т, Т Мюллер, Righini В, Шнееганс М, Zichichi А (1965). «Экспериментальное наблюдение образования антидейтронов». Il Nuovo Cimento . 39 (1): 10–14. Bibcode : 1965NCimS..39 … 10M . DOI : 10.1007 / BF02814251 . S2CID 122952224 .
- ^ Dorfan DE, Eades J, Ледерман Л. М., Ли W, Ting CC (июнь 1965 г.). «Наблюдение за антидейтронами». Phys. Rev. Lett . 14 (24): 1003–1006. Bibcode : 1965PhRvL..14.1003D . DOI : 10.1103 / PhysRevLett.14.1003 .
- ^ Шардонне Р, J Орловым, Salati Р (1997). «Производство антивещества в нашей галактике». Физика Письма Б . 409 (1–4): 313–320. arXiv : astro-ph / 9705110 . Bibcode : 1997PhLB..409..313C . DOI : 10.1016 / S0370-2693 (97) 00870-8 . S2CID 118919611 .
Внешние ссылки [ править ]
| Поищите дейтерий в Викисловаре, бесплатном словаре. |
- Центр ядерных данных в KAERI
- «Аннотированная библиография по дейтерию» . ALSOS: Электронная библиотека ядерных вопросов . Архивировано из оригинала 5 мая 2010 года . Проверено 26 ноября 2019 .
- Маллинз, Джастин (27 апреля 2005 г.). «Демонстрация настольного ядерного синтеза» . Новый ученый .
- Ллойд, Робин (21 августа 2006 г.). «В Млечном Пути обнаружен пропавший газ» . Space.com .
| Дейтерий | |
 | |
| Название, символ | Дейтерий, 2H |
|---|---|
| Альтернативные названия | тяжёлый водород, D |
| Нейтронов | 1 |
| Свойства нуклида | |
| Атомная масса | 2,0141017778(4)[1] а. е. м. |
| Дефект массы | 13 135,7216(3)[1] кэВ |
| Удельная энергия связи (на нуклон) | 1 112,283(0)[1] кэВ |
| Изотопная распространённость | 0,0115(70) %[2] |
| Период полураспада | стабильный[2] |
| Спин и чётность ядра | 1+[2] |
| Таблица нуклидов |
Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 г. американским физико-химиком Г. Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Содержание
- 1 Изотопные модификации соединений водорода
- 2 Получение
- 3 История открытия и изучения
- 4 Применение
- 5 Примечания
- 6 Литература
Изотопные модификации соединений водорода
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C.
- Температура кипения −249,5 °C (23,57K).
- Межъядерное расстояние 0,07416 нм[4].
- Энергия диссоциации (при 0K) 439,68 кДж/моль[4].
Содержание дейтерия в природном водороде — 0,011…0,016 ат.%[5]. Так, в морской воде у берегов соотношение атомных концентраций [D]/[Н] составляет (1,55÷1,56)·10−4 (один атом дейтерия на 6410÷6450 атомов протия), в околоповерхностных водах — (1,32÷1,51)·10−4 (1:6600÷7600), в природном газе — (1,10÷1,34)·10−4 (1:7500÷9100)[5].
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Мировое производство дейтерия — десятки тысяч тонн в год. Крупнейшими производителями тяжёлой воды в мире являются Индия, Китай и Иран[6]. В промышленности для получения тяжелой воды (обогащения воды дейтерием) в своей основе служат процессы ионного обмена, в особенности Girdler Sulfide process, использующий изотопный обмен между водой и сероводородом. Также используется многоступенчатый электролиз воды, ректификация воды, аммиака, жидкого водорода и т. д.[4] При электролизе 100 л воды выделяется 7,5 мл 60-процентного D2O[7].
Содержание дейтерия в природной воде в 1,03 раза больше, чем в паре (это коэффициент разделения для данной смеси). Поэтому если после кипячения не всю воду выливать, а подливать к остатку природной воды и снова кипятить, то в воде чайника постепенно будет происходить накопление тяжелой воды. Однако очень медленное, поэтому даже при большом количестве повторений этого процесса содержание тяжелой воды не станет опасным для здоровья, вопреки предположению В. В. Похлебкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[8].
История открытия и изучения
Дейтерий был открыт в 1932 году Гарольдом Юри и его сотрудниками спектральным методом.
Резерфорд, недовольный предложенным открывателями названием «дейтон»[9], предложил вариант названия — «диплоген», а ядро, соответственно, — «диплон».
Учёные высказывали гипотезу о существовании стабильных изотопов лёгких элементов ещё в 1913 году при изучении неона. Существование этих изотопов было доказано в 1920 году методом масс-спектрометрии. Правда, в то время преобладала теория, согласно которой изотопы различались числом «внутриядерных электронов» различных атомов элемента (нейтрон был открыт позже — в 1932 году). Измерения относительной атомной массы водорода дали значение, близкое к 1 а. е. м., которое равно массе протона. Поэтому предполагалось, что водород не может содержать внутриядерный электрон, иначе он скомпенсирует заряд ядра. Таким образом, считалось, что у водорода нет тяжёлых изотопов.
Дейтерий впервые был открыт химиком Гарольдом Юри, работавшим в Колумбийском университете в конце 1931 года. Фердинанд Брикведде, который помогал Юри, провёл дистилляцию пяти литров жидкого водорода, полученного в криогенном цикле. Брикведде работал в новой лаборатории низких температур, открытой в Национальном бюро стандартов и весов США (NIST). В результате объём жидкости составил 1 мл. Ранее такая же методика использовалась для наработки тяжелых изотопов неона. Техника испарения жидкого водорода позволила увеличить долю изотопа водорода с массой 2 до такой степени, чтобы его можно было надежно зарегистрировать методами спектроскопии[10].
15 июня 1933 года Юри, Мерфи и Брикведде направили письмо редактору научного журнала «The Journal of Chemical Physics», в котором предложили названия для изотопов водорода — протий (англ. protium), дейтерий (англ. deuterium) и тритий (англ. tritium; в случае его открытия, поскольку на тот момент тритий ещё не был открыт), в письме они отмечали, что произвели первые два названия от греческих слов «protos» («первый») и «deuteros» («второй»)[11][12]. В 1934 году Юри была присуждена Нобелевская премия по химии за открытие дейтерия.
Применение
Наибольшие количества дейтерия применяются в атомной энергетике[6]. Он обладает самыми лучшими свойствами замедления нейтронов. В смеси с тритием или в соединении с литием-6 (гидрид лития 6LiD) применяют для термоядерной реакции в водородных бомбах. При взрыве происходят реакции:
D (d, γ) 4He, D (t, n) 4He
Также применяется в качестве меченого стабильного индикатора в химических, биологических и других лабораторных исследованиях и технике[6]. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER)[6].
С некоторых пор дейтерий используется в медицине компаниями, разрабатывающими лекарства, которые с его помощью пытаются увеличить время метаболизма лекарства, то есть замедлить его вывод из организма, это замедление в модифицированных дейтерием лекарствах наблюдается благодаря первичному дейтериевому изотопному эффекту — уменьшению скорости реакции разрыва углерод-дейтериевых связей по сравнению с углерод-протиевыми[13][14].
Также дейтерий используется в нейтронных генераторах[6].
Примечания
- ↑ 1 2 3 Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ Кузьменко, 2007, с. 298.
- ↑ 1 2 3 Бердоносов С. С. Дейтерий // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ 1 2 Дейтерий / В кн.: Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ 1 2 3 4 5 Александр Семёнов. Дейтерий и тритий: водород, да не тот // Наука и жизнь. — 2018. — № 8. — С. 45-51.
- ↑ Кузьменко, 2007, с. 299.
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ М. Олифант. Дни Кембриджа // Rutherford. Recollections of the Cambridge days». Elsevier, Amsterdam, 1972. (рус.)
- ↑ Urey H., Brickwedde F., Murphy G. A Hydrogen Isotope of Mass 2 (англ.) // Physical Review. — 1932. — Vol. 39. — P. 164—165. — DOI:10.1103/PhysRev.39.164. — Bibcode: 1932PhRv…39..164U.
- ↑ Urey H. C., Murphy G. M., Brickwedde F. G. (1933). «A Name and Symbol for H2*». The Journal of Chemical Physics 1: 512-513. DOI:10.1063/1.1749325.
- ↑ Dan O’Leary (2012). «The deeds to deuterium». Nature Chemistry 4: 236. DOI:10.1038/nchem.1273.
- ↑ Michael J. Barratt, Donald E. Frail. Drug Repositioning: Bringing New Life to Shelved Assets and Existing Drugs. — John Wiley & Sons, 2012. — P. 319.
- ↑ Graham L. Patrick. An Introduction to Drug Synthesis. — Oxford University Press, 2015. — P. 380.
Литература
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. — М.: Изд-во Экзамен, 2007. — Т. 1. — С. 299.






![{displaystyle mu ={frac {1}{4(j+1)}}left[({g^{(s)}}_{p}+{g^{(s)}}_{n}){big (}j(j+1)-l(l+1)+s(s+1){big )}+{big (}j(j+1)+l(l+1)-s(s+1){big )}right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c23357e4baf596b679ef024306fab09a5396a8)

